PUBLIÉ LE 14/11/2025
Défaut qualité lénalidomide : les mesures de réduction des risques doivent être strictement respectées
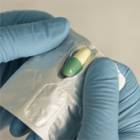
Le laboratoire Arrow a signalé la présence d’une très faible quantité de poudre à l’extérieur des gélules, dans certaines alvéoles de plaquettes de lénalidomide. Tous les dosages peuvent être concernés.
Pour garantir la sécurité des soignants et aidants, le laboratoire a mis en place, à la demande de l’ANSM, un contrôle visuel systématique des plaquettes avant leur mise sur le marché. Les boîtes sont donc susceptibles d’avoir été ouvertes à la réception. Nous demandons aux pharmaciens hospitaliers d’effectuer également cette vérification avant la dispensation aux patients ou l’envoi dans les services de soins.
Nous alertons les soignants, les aidants et les proches des patients sur les risques associés à la manipulation des gélules de lénalidomide : les femmes enceintes ou en âge d’avoir des enfants ne doivent pas entrer en contact avec la poudre de ce médicament, car il présente un risque tératogène connu, c’est-à-dire qu’il peut provoquer des malformations ou le décès du fœtus.
À ce stade, un défaut similaire ne peut être exclu pour les boîtes de lénalidomide des autres laboratoires, qui mènent actuellement des investigations en ce sens. Nos recommandations seront actualisées en fonction de leurs résultats.
Nous invitons toute personne amenée à manipuler les plaquettes de lénalidomide à redoubler de vigilance et à suivre strictement les recommandations de sécurité que nous rappelons ci-dessous.
À la suite du défaut qualité constaté sur un lot de lénalidomide Viatris, nous avons demandé à tous les laboratoires commercialisant du lénalidomide en France de mener des investigations par mesure de précaution. Le laboratoire Arrow a signalé, à l’issue de ces investigations, avoir identifié la présence de poudre dans un très petit nombre d’alvéoles de ses plaquettes de lénalidomide. L’origine du défaut a été identifiée et des actions correctives ont été mises en œuvre par le laboratoire Arrow.Dans la mesure où ce défaut intervient dans un contexte de tensions d’approvisionnement existantes et afin d’éviter toute rupture de stock, les lots concernés ne sont pas rappelés. En revanche, toutes les plaquettes sont contrôlées par le laboratoire avant leur distribution, à notre demande. Ce contrôle peut être effectué à différentes étapes du circuit de production et, dans certains cas, nécessite l’ouverture des boîtes. Pour cette raison, des boîtes pourraient ne plus présenter de dispositif antieffraction.
Nous demandons aux pharmaciens hospitaliers de procéder, avant toute dispensation, à une vérification visuelle des plaquettes pour s’assurer de l’absence de poudre libre, même s’il est possible que ce défaut soit parfois peu visible en raison de la faible quantité de poudre.
Dans les services de soins, une vérification finale doit également être effectuée par les soignants avant de manipuler la plaquette.
Nous rappelons que vous devez :
- Porter des gants jetables au moment de la manipulation des plaquettes d’emballage ou des gélules de lénalidomide ;
- Retirer vos gants avec précaution pour éviter tout contact avec le produit et les jeter immédiatement ;
- Puis vous laver soigneusement les mains au savon et à l’eau.
Information pour les patients, leurs aidants et les soignants
Le lénalidomide est un médicament tératogène, c’est-à-dire qu’il peut provoquer des malformations graves, voire le décès du fœtus.
Le traitement par lénalidomide ne doit être ni arrêté ni modifié sans avis médical.
Avant toute dispensation, le pharmacien hospitalier procède à une vérification visuelle afin de s’assurer de l’absence de poudre dans les alvéoles. Il vous remettra avec votre médicament un courrier d’information rappelant les mesures de réduction des risques lors de la manipulation des gélules.
Avant de manipuler une plaquette pour prendre une gélule, vérifiez l’absence de poudre hors des gélules. Si vous observez de la poudre dans une ou plusieurs alvéoles, n’ouvrez pas la plaquette et rapportez la boîte à votre pharmacien hospitalier.
Cependant, si vous êtes enceinte ou que vous pensez l’être et que vous avez été en contact avec de la poudre de lénalidomide, prévenez immédiatement votre médecin. Il pourra vous orienter vers un spécialiste pour évaluer la nécessité d’examens complémentaires.
Nous rappelons que vous devez mettre des gants jetables avant toute manipulation des plaquettes ou des gélules de lénalidomide. Retirez ensuite les gants avec précaution, jetez-les immédiatement et lavez-vous soigneusement les mains au savon et à l’eau.
Le traitement par lénalidomide ne doit être ni arrêté ni modifié sans avis médical.
Avant toute dispensation, le pharmacien hospitalier procède à une vérification visuelle afin de s’assurer de l’absence de poudre dans les alvéoles. Il vous remettra avec votre médicament un courrier d’information rappelant les mesures de réduction des risques lors de la manipulation des gélules.
Avant de manipuler une plaquette pour prendre une gélule, vérifiez l’absence de poudre hors des gélules. Si vous observez de la poudre dans une ou plusieurs alvéoles, n’ouvrez pas la plaquette et rapportez la boîte à votre pharmacien hospitalier.
Cependant, si vous êtes enceinte ou que vous pensez l’être et que vous avez été en contact avec de la poudre de lénalidomide, prévenez immédiatement votre médecin. Il pourra vous orienter vers un spécialiste pour évaluer la nécessité d’examens complémentaires.
Rappel des précautions de manipulation
Les femmes enceintes ou en âge d’avoir des enfants ne doivent pas entrer en contact avec ce produit.Nous rappelons que vous devez mettre des gants jetables avant toute manipulation des plaquettes ou des gélules de lénalidomide. Retirez ensuite les gants avec précaution, jetez-les immédiatement et lavez-vous soigneusement les mains au savon et à l’eau.
Information pour les pharmaciens hospitaliers
Le laboratoire Arrow a procédé à un contrôle visuel systématique des boîtes de lénalidomide avant leur envoi. En conséquence, certaines boîtes que vous recevrez peuvent être ouvertes ou ne plus comporter de dispositif antieffraction.
Lors de chaque dispensation, nous vous demandons d’ouvrir les boîtes de lénalidomide pour vérifier l’absence de poudre hors des gélules. Attention, la poudre peut être peu visible.
Si vous constatez qu’il y a de la poudre sur une plaquette ou dans une alvéole, détruisez la boîte concernée.
Dispensez une boîte sans ce défaut qualité. Des courriers accompagneront les boîtes de lénalidomide afin de rappeler aux patients les mesures additionnelles de réduction des risques. Veillez à les remettre aux patients en leur expliquant la situation.
Ne manipulez pas les plaquettes ou les gélules si vous êtes enceinte ou susceptible de l'être.
Lors de chaque dispensation, nous vous demandons d’ouvrir les boîtes de lénalidomide pour vérifier l’absence de poudre hors des gélules. Attention, la poudre peut être peu visible.
Si vous constatez qu’il y a de la poudre sur une plaquette ou dans une alvéole, détruisez la boîte concernée.
Dispensez une boîte sans ce défaut qualité. Des courriers accompagneront les boîtes de lénalidomide afin de rappeler aux patients les mesures additionnelles de réduction des risques. Veillez à les remettre aux patients en leur expliquant la situation.
Rappel des précautions de manipulation
Nous rappelons qu’il convient de porter des gants jetables au moment de la manipulation des plaquettes ou des gélules de lénalidomide. Retirez ensuite les gants avec précaution, jetez-les immédiatement et lavez-vous soigneusement les mains au savon et à l’eau.Ne manipulez pas les plaquettes ou les gélules si vous êtes enceinte ou susceptible de l'être.
 Consultez le courrier à destination des patients et leurs aidants (14/11/2025)
Consultez le courrier à destination des patients et leurs aidants (14/11/2025)