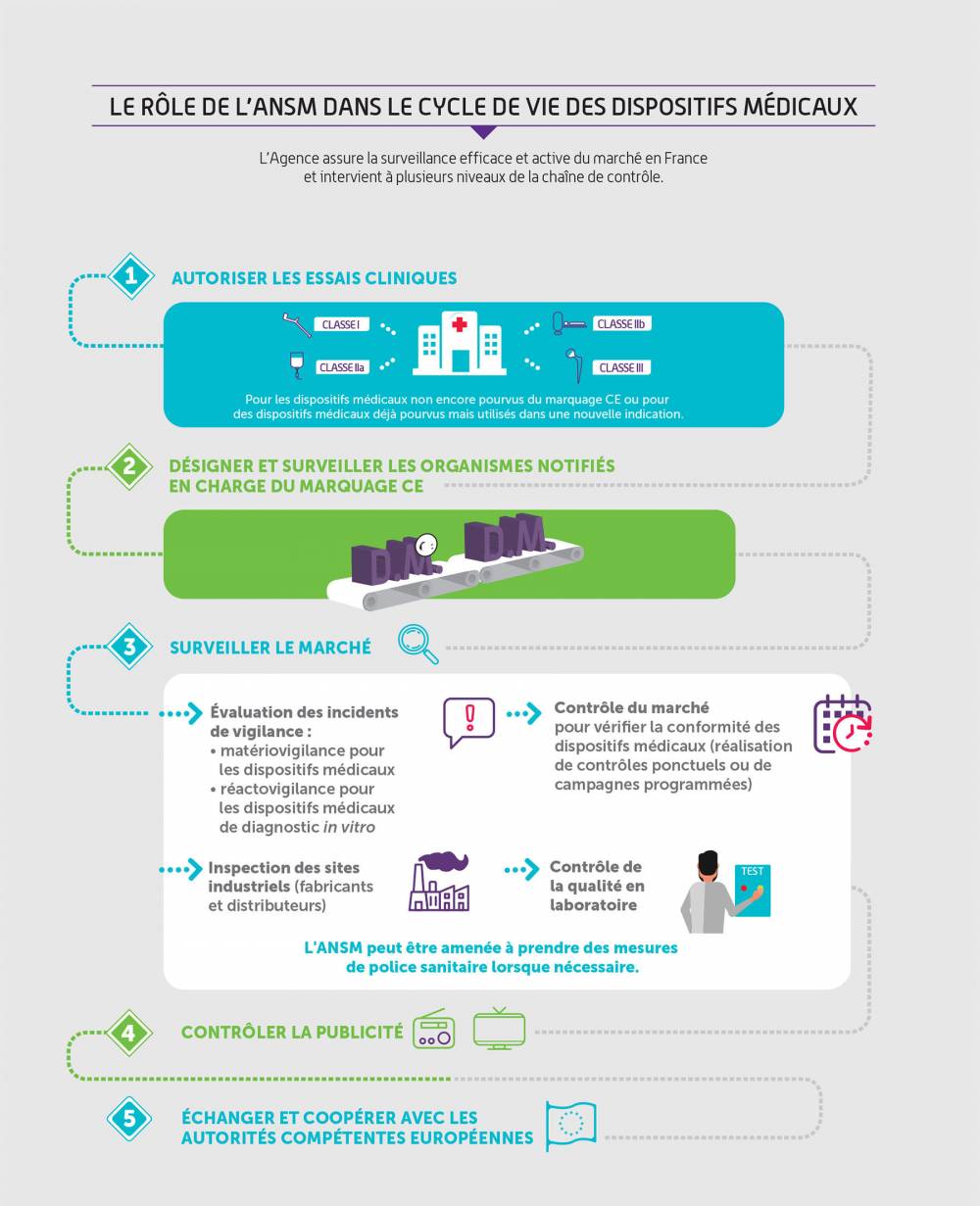
Les dispositifs médicaux et les dispositifs médicaux de diagnostic in vitro (DMDIV)
Les dispositifs médicaux
Un dispositif médical (DM) correspond à tout instrument, appareil, équipement, matière, produit (à l’exception des produits d’origine humaine), y compris les accessoires et logiciels, utilisé seul ou en association, à des fins médicales chez l’homme, et dont l’action principale voulue n’est pas obtenue par des moyens pharmacologiques, immunologiques ou métaboliques.Le marché des dispositifs médicaux est très vaste et le secteur très innovant. Le tissu industriel est multiple et diversifié, comprenant à la fois de grandes multinationales et de toutes petites et moyennes entreprises.
Il comporte plus de 20 000 types de produits, allant des consommables à usage unique ou réutilisables (pansements, compresses, etc.), aux implants (prothèses mammaires, stimulateurs cardiaques, etc.) en passant par les équipements (lits médicaux…).

Les différentes classes de dispositifs médicaux
Les dispositifs médicaux sont classés en fonction du niveau de risque lié à leur utilisation (durée d’utilisation, partie du corps exposée, à l’intérieur ou à l’extérieur du corps) et des risques potentiels liés à leur utilisation pour la santé publique (classe I à III).Ces classes de risques traduisent également, en corollaire, le bénéfice médical attendu pour le patient.
- Classe I (classe de risque la plus faible) : par exemple les compresses, les lunettes, les béquilles, etc. ;
- Classe IIa (risque potentiel modéré/mesuré) : par exemple les lentilles de contact, les appareils d’échographie, les couronnes dentaires, etc. ;
- Classe IIb (risque potentiel élevé/important) : par exemple les préservatifs, les produits de désinfection des lentilles, etc. ;
- Classe III (classe de risque la plus élevée) : par exemple les implants mammaires, les stents, les prothèses de hanche, etc.
Les dispositifs médicaux de diagnostic in vitro
Un dispositif médical de diagnostic in vitro est un produit ou instrument, y compris les accessoires et logiciels, destiné par son fabricant à être utilisé in vitro dans l’examen d’échantillons provenant du corps humain (sang, urine, tissus, etc.), dans le but de fournir une information, notamment sur l’état physiologique ou pathologique d’une personne ou sur une anomalie congénitale.Les tests (test Covid-19, test de grossesse, test pour le dosage de la glycémie, etc.), appelés aussi "réactifs", utilisés en laboratoire pour réaliser les analyses de biologie appartiennent notamment à cette catégorie.
Les différentes groupes de dispositifs médicaux de diagnostic in vitro
Le règlement (UE) 2017/746 identifie plusieurs groupes de DMDIV.Cette classification prescriptive établit des « listes » (A et B) qui incluent les DMDIV présentant un risque élevé pour les patients et pour la santé publique. En fonction de leur appartenance ou non à ces listes, les DMDIV en question ne répondent pas aux mêmes exigences de conformité.
La directive distingue également des DMDIV d’autodiagnostic et des DMDIV destinés à l’évaluation des performances et des DMDIV qui ne sont ni de la liste A, ni de la liste B ou d’autodiagnostic.