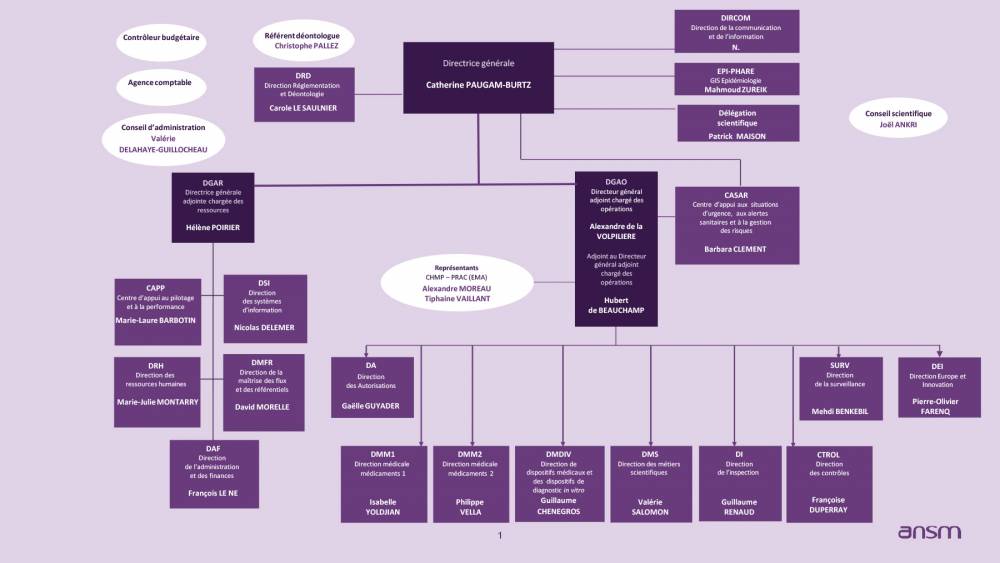
La Direction générale
La directrice ou le directeur général de l'ANSM s’appuie dans ses missions sur une direction générale adjointe en charge des opérations (DGAO) et une direction générale adjointe chargée des ressources (DGAR). Lui sont également rattachés la direction réglementation et déontologie, la direction de la communication et de l’information, la délégation scientifique et le GIS EPI-PHARE.
Nous travaillons selon une approche collégiale, transversale et transparente en entretenant notamment un dialogue permanent avec nos parties prenantes afin de prendre des décisions adaptées qui s'appuient sur les avis de plusieurs comités consultatifs, au sein desquels l’expertise des représentants de la société civile, leur point de vue et leur vision du monde de la santé contribuent à la prise de décisions objectives et éclairées.
Deux instances sont chargées de la gouvernance de l'ANSM : un Conseil d’administration et un Conseil scientifique.
En savoir plus sur nos instances
Deux instances sont chargées de la gouvernance de l'ANSM : un Conseil d’administration et un Conseil scientifique.
Présentation des services et directions
L’organisation de nos directions et services répond aux enjeux de l’ANSM qui sont inscrits dans le contrat d’objectifs et de performance signé avec l’Etat : une politique d’ouverture et de transparence auprès des usagers, une stratégie de gestion du risque comme principe commun à toutes nos décisions, un renforcement de notre positionnement européen et la stabilisation de notre performance à délivrer des services plus sûrs et plus efficaces répondant aux attentes de nos publics.La direction Réglementation et déontologie
Rattachée à la directrice ou au directeur général de l'ANSM, la direction Réglementation et déontologie assure la sécurité juridique et réglementaire des décisions de l’établissement, prend en charge le respect de la réglementation de la protection des données personnelles, les relations avec les parlementaires et l’interface avec les missions de contrôle. Elle participe à la rédaction des textes relatifs au champ de compétence de l’Agence en appui du ministère chargé de la Santé et à l’évolution de la législation et de la réglementation au niveau européen. Elle pilote la politique des sanctions financières, assure la gestion des demandes d’accès aux documents administratifs (loi CADA), les relations avec la CNIL ainsi que le suivi des alertes externes. D’un point de vue réglementaire, elle coordonne les conditions de prescription et de délivrance des médicaments et prend en charge les activités d’importation et d’exportation des médicaments et des pâtes plasmatiques ainsi que la qualification des produits de santé et des recherches sur la personne humaine.Un service déontologie, éthique et probité lui est intégré. Ce service apporte appui, conseil et expertise juridique à l’ensemble des services de l’Agence dans la prévention et la gestion des situations potentielles de conflit d’intérêts. Ce service mène également des actions d’information et de formation en matière de déontologie auprès de l’ensemble des agents ou auprès des membres d’instances nouvellement nommés.
La directrice de la direction Réglementation et Déontologie est déontologue de l’ANSM. Elle travaille en étroite relation avec le référent déontologue de l’ANSM qui constitue un appui externe en matière de déontologie de la Fonction publique.
Le référent déontologue a un rôle de conseil et d’appui à la direction générale sur toute question d’ordre général relative à la déontologie et à la prévention des conflits d’intérêts, ainsi que sur l’environnement de contrôle relatif à la déontologie. En outre, la direction générale peut le saisir en cas de doute sérieux lié à une situation de mobilité d’un agent. Dans le but d’assurer son indépendance et son impartialité, le référent déontologue ne peut solliciter ni recevoir d’instruction de la directrice générale de l’ANSM.
- drd@ansm.sante.fr
- lanceur.alerte@ansm.sante.fr - Lanceur d’alerte/ signalement concernant une alerte de sécurité sanitaire
- exportation-medicaments@ansm.sante.fr
- importation-medicaments@ansm.sante.fr
La direction de la communication et de l’information
Rattachée à la directrice ou au directeur général de l'ANSM, la direction de la communication et de l’information est en charge de la définition et du pilotage de la stratégie de communication et d’information de l’Agence. Elle intervient en transverse auprès de l’ensemble des agents et des équipes en interne et de l’ensemble de nos publics en externe. Elle est particulièrement impliquée dans la politique de gestion de risques, la politique d’ouverture aux parties prenantes et l’ambition de l’ANSM de mener des politiques publiques inscrites dans le Contrat d’objectif et de performance 2024-2028 de l’ANSM. La direction de la communication et de l’information pilote le comité d’interface avec les associations de patients ou d’usagers du système de santé ainsi que le comité d’interface avec les représentants des pharmaciens.Le Centre d’Appui aux Situations d’urgence, aux Alertes sanitaires et à la gestion des Risques (CASAR)
Rattaché à la direction générale de l’ANSM, le CASAR a pour objectif de faciliter la gestion des alertes les plus sensibles et ainsi favoriser la capacité de réponse de l’Agence. Il effectue une analyse de risques intégrant notamment l’impact sociétal, l’acceptabilité de la situation, la maîtrise des risques. Il crée ensuite les conditions de la concertation interne, en vue d’établir rapidement les mesures immédiates de réduction des risques.La délégation scientifique
La délégation joue un rôle d’animation, de coordination et de propositions stratégiques transversales et d’ouverture scientifique. Elle a pour ambition d’enrichir la stratégie scientifique de l’ANSM en favorisant le développement de politiques de santé publique avec l’appui du collège des conseillers et du Conseil scientifique. Elle a également pour mission d’impulser la politique de la valorisation des données de santé publique en lien avec la politique gouvernementale.Le groupement d’intérêt scientifique EPI-PHARE
Pour une prise de décision indépendante, éclairée et rapide dans le domaine de la sécurité du médicament et autres produits de santé, les pouvoirs publics doivent pouvoir s’appuyer sur une expertise publique autonome et réactive en matière de pharmaco-épidémiologie et de sécurité sanitaire, capable de réaliser les études nécessaires.Fortes de leurs compétences reconnues et leur capacité à pouvoir réaliser en routine des études de pharmaco-épidémiologie basées sur les données complexes et massives du Système national des données de santé (SNDS), l’ANSM et la Caisse Nationale d’Assurance Maladie (Cnam) ont ainsi créé fin décembre 2018 le Groupement d’Intérêt Scientifique EPI-PHARE.
EPI-PHARE réalise, pilote et coordonne des études de pharmaco-épidémiologie à partir des données complexes et massives du SNDS, pour éclairer les pouvoirs publics dans leur prise de décision.
Les directions médicales
Au nombre de deux pour les médicaments, avec des champs répartis par gamme thérapeutique, leur organisation a été repensée en lien avec la direction des autorisations et la direction des métiers scientifiques pour permettre un dialogue renforcé avec les usagers dans le cadre de l’instruction des dossiers mais aussi grâce à l’animation collégiale des comités permanents qui relèvent de leur domaine d’activité. En cela, elles portent l’ouverture aux parties prenantes par la relation directe avec les associations de patients et les représentants des professionnels de santé.DMM1 - Médicaments indiqués dans le traitement de : Oncologie, oncohématologie, hématologie, néphrologie, greffe, thérapie cellulaire, transfusion, médicaments dérivés du plasma, radio-pharmaceutiques, agents de contraste, cardiologie, vaisseaux thrombose réanimation, antidotes stomatologie, ophtalmologie, Endocrinologie (diabétologie), gynéco-obstétrique, urologie, allergologie, pneumologie, ORL
DMM2 - Médicaments indiqués dans le traitement de : Psychiatrie, neurologie, antalgie, anesthésie rhumatologie, médicaments des addictions, dermatologie, déficits enzymatiques, médecine interne, hépatologie, gastro-entérologie, vaccins et antiinfectieux, virologie, maladies émergentes, régulation des flux des stupéfiants et psychotropes
- dmm2@ansm.sante.fr
- stupetpsy@ansm.sante.fr - Autorisations relatives aux stupéfiants et aux psychotropes (utilisation - importation - exportation - déclaration annuelle - déclaration de vol)
DMDIV - Dispositifs médicaux et dispositifs médicaux de diagnostic in vitro
La direction médicale des dispositifs médicaux et dispositifs de diagnostic in vitro, avec un champ d’intervention couvrant l’ensemble des disciplines médicales a pour principale mission d’assurer la sécurité des patients par une identification précoce des risques et la mise en œuvre de plans d’actions pour maîtriser ces risques y compris des actions de surveillance du marché adaptées. Elle émet également des avis scientifiques et réglementaires et participe activement, en tant qu’autorité compétente désignée pour la France, aux différents travaux européens pour la mise en application de la réglementation applicable aux dispositifs médicaux et dispositifs de diagnostic in vitro.- dmcdiv@ansm.sante.fr
- EC.DM-COS@ansm.sante.fr - Essais cliniques - Dispositifs médicaux et dispositifs médicaux de diagnostics in vitro
- cnq.labm@ansm.sante.fr - Contrôle national de qualité des analyses de biologie médicale
- cqdm@ansm.sante.fr - Contrôle qualité des dispositifs médicaux
La direction des autorisations
Avec un pilotage centralisé et coordonné des dossiers d’autorisation de mise sur le marché (hors procédures centralisées) et d’essais cliniques (hors phases précoces), la direction des autorisations a pour rôle de sécuriser et d’harmoniser le processus d’autorisation des médicaments, notamment en introduisant une analyse de risques et une approche collégiale dans l’instruction des dossiers et en garantissant le pilotage des priorités et des délais, dans l’intérêt des patients. Elle constitue désormais le point d’entrée unique pour les industries et les opérateurs de santé.La direction Europe et innovation
La direction Europe et Innovation a pour mission de coordonner la politique d’innovation, de recherche clinique et d’accès précoce et compassionnel en lien avec les directions médicales et la direction des métiers scientifiques et la mise en oeuvre de la stratégie européenne en matière d’évaluation des médicaments. Elle est également la direction chargée de la représentation de l’Agence dans les principaux comités européens (CHMP, PRAC, CMDh, SAWP, CAT, HMA), où elle porte une vision intégrée de l’accès à l‘innovation, en France et en Europe.- innovation@ansm.sante.fr - Guichet innovation
La direction des métiers scientifiques
Par son approche scientifique d’excellence, la direction des métiers scientifiques a pour mission de sécuriser la qualité des produits en intégrant une approche pluridisciplinaire dans l’évaluation des produits et l’instruction des dossiers. En ce sens, elle porte l’ouverture aux parties prenantes visant à renforcer la confiance sur les sujets relatifs à la toxicité et à la qualité pharmaceutique des produits biologiques et chimiques. La direction porte l’autorité nationale de Pharmacopée. Elle “veille à la santé des produits”.- contactspharmacopeefrancaise@ansm.sante.fr - Pharmacopée française
- preparations@ansm.sante.fr - Préparations
La direction de la surveillance
La direction de la surveillance participe à la surveillance des produits de santé par ses activités transversales de pharmacovigilance, addictovigilance, hémovigilance, matériovigilance, réactovigilance et de vigilance des essais cliniques. Elle organise la détection des signaux ou des effets indésirables non connus, la priorisation par le risque des dossiers en vue de leur analyse par les directions médicales, la sécurisation des mesures à travers l’organisation d’échanges collégiaux internes et avec les réseaux de vigilance, le pilotage d’activités de vigilance des directions médicales et l’administration des bases de données. Cette mission de surveillance est également réalisée de façon proactive pour identifier un risque a priori, même en l’absence de signal. La direction de la surveillance regroupe en sus des expertises spécifiques dans les domaines de la grossesse, la reproduction et l’allaitement, la prévention et la gestion des erreurs médicamenteuses, du contrôle de la publicité et du cannabis médical. Elle contribue à la politique de transparence des données de vigilance et pilote et coordonne deux politiques de santé publique relatives à la grossesse et la prévention du mésusage.- pharmacovigilance@ansm.sante.fr - Pharmacovigilance
- reactovigilance@ansm.sante.fr - Réactovigilance
- visapublicite@ansm.sante.fr - Visa publicité
La direction de l’inspection
La direction de l’inspection veille à la qualité des pratiques des opérateurs (fabricants, exploitants, importateurs, distributeurs, promoteurs d’essais cliniques, investigateurs, installations d’essais…) ainsi qu’à la qualité et la sécurité des produits de santé, y compris des matières premières. Elle contribue à définir les cadres réglementaires opposables (notamment les bonnes pratiques), au niveau national, communautaire et/ou international ; elle gère les établissements (autorisations, agréments, déclarations, sanctions…) et s’assure que les dispositions réglementaires opposables sont mises en oeuvre, par des inspections sur le terrain (en France ou à l’étranger) dans le cadre d’un programme annuel ou inopinées. Elle gère les signalements relatifs aux défauts qualité des médicaments et substances actives, ainsi que les signalements pouvant conduire à une inspection pour les autres produits de santé et les essais cliniques. Enfin, elle contribue à la lutte contre les pénuries de médicaments, en veillant à la disponibilité des médicaments d’intérêt thérapeutique majeur et de ceux dont l’indisponibilité peut entraîner un risque de santé publique. Elle coordonne en lien avec les autres directions de l’agence, les actions qui doivent être menées par les laboratoires pharmaceutiques afin de sécuriser l’accès à ces médicaments pour les patients.- insevi@ansm.sante.fr - Inspection des essais et des vigilances
- BPC@ansm.sante.fr - Essais cliniques - Bonnes pratiques cliniques et inspection
- BPL@ansm.sante.fr - Bonnes pratiques de laboratoire et inspection
- insmp@ansm.sante.fr - Inspection des matières premières
- insbio1@ansm.sante.fr - Inspection des produits biologiques
- Inspection.PSL@ansm.sante.fr - Inspection des produits biologiques/ Produits sanguins labiles
- biosecurite@ansm.sante.fr - Inspection des produits biologiques/Micro-organismes et toxines
- ipplf@ansm.sante.fr - Inspection des produits pharmaceutiques et lutte contre les fraudes
- fraude@ansm.sante.fr - Inspection des produits pharmaceutiques et lutte contre les fraudes
- insmar.dm@ansm.sante.fr - Inspection en surveillance du marché/ établissements concernant les dispositifs médicaux
- insmar.div@ansm.sante.fr - Inspection en surveillance du marché/ établissements concernant les dispositifs médicaux de diagnostic in vitro
- insmp@ansm.sante.fr - Enregistrement et inspection des établissements de fabrication, distribution et importation de matières premières à usage pharmaceutique
- rupture-stock@ansm.sante.fr - Ruptures de stock et d’approvisionnement
- dvs.defauts-qualite@ansm.sante.fr - Défauts qualité
La direction des contrôles
La direction des contrôles mène deux missions principales : la vérification de la qualité intrinsèque des produits en laboratoire selon une approche de surveillance du marché, dans le cadre de programmes de surveillance européens et internationaux en relation avec la direction Européenne de la Qualité du Médicament et soins de santé (EDQM), l’Agence Européenne du Médicament (EMA) et l’Organisation Mondiale de la Santé (OMS), ou en urgence et une activité de contrôle et de libération des lots de médicaments immunologiques (vaccins) et des médicaments dérivés du sang avant leur mise sur le marché, pour le marché français et pour le marché européen dans le cadre des procédures pilotées par l’EDQM pour le réseau des laboratoires officiels de contrôles (OMCLs),dont l’ANSM fait partie. Elle est à ce titre le laboratoire officiel national.Elle agit également pour les marchés internationaux dans le cadre de la procédure de préqualification de l’OMS et contribue au développement de méthodes de contrôle et/ou à la qualification de substances de référence et participe à l’élaboration de référentiels en coopération avec des structures de normalisation ou de standardisation.
La direction de la maitrise des flux et des référentiels
La direction de la maitrise des flux et des référentiels est un maillon important dans la chaine « métier ». Elle est le premier interlocuteur concernant la soumission et la traçabilité des dossiers. Elle alimente le répertoire des spécialités pharmaceutique, la base publique du médicament et plusieurs référentiels métiers. Cette direction contrôle le circuit documentaire et pilote la politique d’archivage de l’Agence, la constitution des Archives historiques et leur transfert aux Archives Nationales. Elle gère également le service d’accueil des usagers.- declaration.CODELPP@ansm.sante.fr - Déclaration des codes LPP
- communications.DM@ansm.sante.fr - Déclaration et communication pour les dispositifs médicaux et les opérateurs
- pgref@ansm.sante.fr - Transmission des adresses mail génériques des titulaires d’AMM
- rh@ansm.sante.fr - Direction des ressources humaines
- dpi@ansm.sante.fr - Déclaration d’intérêts des experts
- ansm-factures@ansm.sante.fr - Factures-Fournisseurs
- experts.missions@ansm.sante.fr - Frais de mission experts