PUBLIÉ LE 06/05/2025
Rappel de lots de Lisinopril 5 mg Viatris en raison d’un défaut qualité de l’emballage
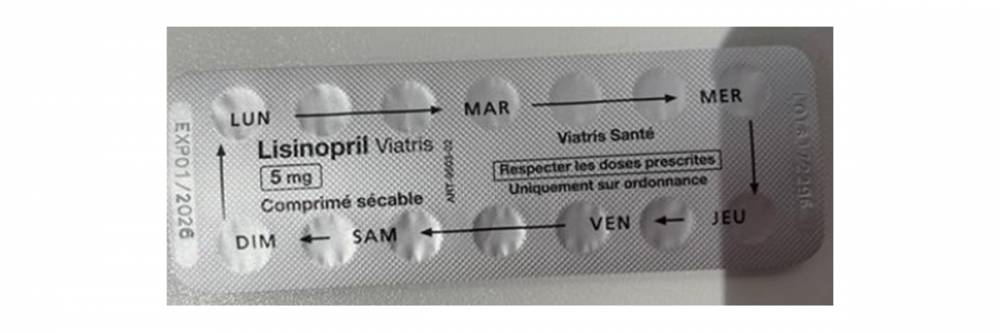
Nous avons été informés par le laboratoire Viatris d’un défaut d’impression sur les plaquettes de plusieurs lots de Lisinopril 5 mg comprimé sécable, pouvant induire un risque de surdosage.
En accord avec l’ANSM, le laboratoire procède au rappel des lots concernés : les patients sont invités à rapporter leur boîte en pharmacie pour échange.
Quatre lots de Lisinopril 5 mg Viatris sont concernés :- Boîte de 28 comprimés sécables : lot 8172295, péremption 01/2026 et lot 8189879, péremption 03/2027 ;
- Boîte de 84 comprimés sécables : lot 8172296, péremption 01/2026 et lot 8192737, péremption 03/2027.
L’inscription présente sur l’aluminium de la plaquette peut prêter à confusion car elle laisse penser qu’il faut prendre plusieurs comprimés certains jours. Il y a donc un risque d’erreur de prise en surnombre par les patients.
La qualité des comprimés n’est pas remise en cause.
À ce jour, un cas de surdosage accompagné d’un état confusionnel non grave a été rapporté, sans conséquences graves pour le patient.
Aucune tension d’approvisionnement en lisinopril n’est attendue suite à ce rappel car des alternatives sont disponibles.
De nouveaux lots avec des plaquettes conformes seront prochainement disponibles.
Aucune tension d’approvisionnement en lisinopril n’est attendue suite à ce rappel car des alternatives sont disponibles.
De nouveaux lots avec des plaquettes conformes seront prochainement disponibles.
Informations pour les patients
Comment savoir si ma boîte est concernée ?
Le numéro de lot figure sur l’emballage extérieur du médicament (boîte en carton).Si la boîte de Lisinopril Viatris 5 mg indique:
- Lot 8172295 ou lot 8189879 (boîte de 28 comprimés sécables),
- Lot 8172296 ou lot 8192737 (boite de 84 comprimés sécables),
En cas de doute, rapportez-la en pharmacie où un pharmacien vérifiera le numéro de lot.
Ma boite est concernée par le rappel, que dois-je faire ?
N'arrêtez pas votre traitement et rapportez la boîte en pharmacie. Le pharmacien vous la remplacera par une autre boîte de lisinopril 5 mg (pouvant provenir d’un autre laboratoire que Viatris). Respectez toujours la dose prescrite par le médecin et indiquée sur l’ordonnance.Quels sont les risques en cas de surdosage ?
En cas de surdosage, vous pouvez éprouver de la fatigue, des troubles de l’équilibre, une hypotension. Une altération de la fonction rénale peut survenir. Ces effets indésirables peuvent être plus forts si vous souffrez d’insuffisance rénale. Si vous ressentez des effets indésirables, contactez un médecin.Informations pour les pharmaciens
Contactez les patients à qui vous avez délivré une boîte de :
Lisinopril Viatris 5 mg :
Si un patient vous rapporte directement une boite, vérifiez systématiquement le numéro de lot. Si elle est concernée par le rappel, procédez à un échange avec une boite d’une spécialité équivalente de lisinopril 5 mg.
Vérifiez s’il vous reste des boîtes concernées par le rappel dans votre stock.
Retournez les boîtes rappelées à votre grossiste.
Lisinopril Viatris 5 mg :
- 28 comprimés sécables : lot 8172295 ou lot 8189879,
- 84 comprimés sécables : lot 8172296 ou lot 8192737,
Si un patient vous rapporte directement une boite, vérifiez systématiquement le numéro de lot. Si elle est concernée par le rappel, procédez à un échange avec une boite d’une spécialité équivalente de lisinopril 5 mg.
Vérifiez s’il vous reste des boîtes concernées par le rappel dans votre stock.
Retournez les boîtes rappelées à votre grossiste.
RAPPEL DE PRODUIT
Médicaments
Publié le 06/05/2025
Lisinopril Viatris 5 mg, comprimé sécable – Viatris Santé
Niveau de rappel : officines, circuit de distribution pharmaceutique et patients