Les principes de bonnes pratiques de laboratoire (BPL) constituent un système de garantie de la qualité du mode d’organisation et de fonctionnement des laboratoires ( dénommés "installations d’essai") qui réalisent des essais de sécurité non cliniques sur les produits chimiques.
La finalité des BPL est d'assurer la qualité, la reproductibilité et l’intégrité des données générées à des fins réglementaires. Ainsi reconnues au niveau international elles permettent de limiter la reproduction d’études équivalentes et de réduire l’utilisation des animaux de laboratoire.Processus des inspections BPL
Des inspections sont réalisées de façon régulière, en principe tous les deux ans, pour constituer et tenir à jour les documents sur le respect des BPL des installations d’essai.1 - Entrée dans le programme d'inspection
Les essais de sécurité non cliniques sur le médicament à usage humain, les produits cosmétiques ou de tatouage doivent être déclarés en conformité avec les BPL par les installations qui les réalisent.L’entrée dans le programme d’inspection de l’ANSM se fait majoritairement sur demande de l’installation (lire aussi : Autres modes de déclenchement d’une inspection).
Un premier contact peut se faire par téléphone ou par messagerie électronique auprès des inspecteurs du pôle d’inspection des BPL.
Les activités de l’installation pouvant entrer dans le champ d’application des BPL sont :
- les essais destinés à évaluer la sécurité d’un élément d’essai du champ de compétence de l’ANSM
- les essais non cliniques
- les essais destinés à faire partie d’un dossier réglementaire (dossier de demande d’AMM d’un médicament prévu par l’article L. 5121-8 du CSP, dossier d’un produit cosmétique prévu par l’article L. 5131-6 du CSP ou dossier d’un produit de tatouage prévu par l’article L. 513-10-3 du CSP)
La demande doit être adressée par courrier postal au directeur de l’inspection de l’ANSM ; le courrier renseigne sur le type d’essais de sécurité réalisés et la nature des éléments soumis à essai.
La première inspection n'est planifiée que lorsque la direction de l’installation peut présenter des rapports finaux formellement déclarés conformes aux BPL.
2 - Notification d’inspection
Si les activités de l’installation d’essai sont effectivement du domaine de compétence de l’ANSM, une inspection est notifiée par le directeur de l’inspection (par délégation du directeur général de l’ANSM).Le courrier de notification précise la date d’inspection prévue; il est accompagné d'un dossier "d’état des lieux" à compléter avec l’ensemble des informations relatives aux activités de l’installation entrant dans le domaine des BPL.
3 - Inspection sur site
L’ensemble des activités de l’installation d’essai en relation avec les principes de BPL est évalué au cours de l’inspection, sur la base, notamment, de l’examen d’une ou plusieurs études achevées.4 - Rapport d’inspection
Un rapport préliminaire qui reprend l’ensemble des observations des inspecteurs est émis à la suite de l’inspection.Ces observations sont classées selon leur impact sur la qualité et la fiabilité des données d’étude : observation mineure, majeure ou critique.
A réception du rapport, l’installation d’essai dispose d’un délai qui ne doit pas être inférieur à 2 semaines (15 jours) pour répondre aux observations des inspecteurs, conformément au principe administratif de la procédure contradictoire.
Le rapport final d’inspection établit :
- les conclusions des inspecteurs basées sur les réponses de l’installation d’essai
- une proposition du niveau ou de respect des BPL.
5 - Conclusion de l’inspection sur le respect des BPL
Trois niveaux de respect des BPL sont possibles :- A : l’installation d’essai est considérée conforme aux principes des BPL,
- B : l’installation d’essai présente une conformité partielle avec des déviations mineures ne remettant pas en cause la fiabilité des études,
- C : l’installation d’essai n’est pas conforme aux principes des BPL.
La déclaration de conformité aux BPL établie par l’ANSM à l’issue du contrôle ne permet pas d'attribuer à l’installation d’essai un label de qualité valable pour les études ultérieures.
6 - Cas particulier des dispositifs médicaux (DM)
Le nouveau règlement européen (UE) 2017/745, entré en application le 26 mai 2021, stipule dans le chapitre 6.1.b de l’annexe II concernant les données précliniques : « le cas échéant, il convient de démontrer la conformité avec les dispositions de la directive 2004/10/CE du Parlement européen et du Conseil ».Afin de vérifier cette nouvelle disposition, en septembre 2021 l’ANSM entame un programme d’inspection BPL visant à vérifier les déclarations de conformité des études de sécurité précliniques pour les DM.
Ainsi, lorsque des études précliniques sur DM réalisées par une installation d’essais sont déclarées conformes aux principes de BPL tels qu’énoncés dans la directive 2004/10/CE, ou dans le document de l’OCDE ENV/MC/CHEM(98)17 relatif aux principes de l'OCDE de BPL (tels que révisés en 1997), l’opérateur a la possibilité de formuler auprès de l’ANSM une demande d’intégration dans le programme d’inspection BPL de l’Agence qui est spécifiquement dédié aux DM.
La procédure d’entrée dans ce programme d’inspection est identique à l’entrée dans le programme général, hormis qu’un formulaire d’entrée - dont la trame est disponible sur demande - doit être retourné dument complété avec la lettre de demande d’entrée.
Le processus d’inspection est également identique à celle du programme général, sauf que deux niveaux de degré de conformité sont définis à la fin du processus d’inspection : soit conforme, soit non-conforme aux principes de BPL.
Conséquences de la non-conformité aux BPL
Plusieurs cas d’absence de respect des principes des BPL par une installation d’essai sont envisageables :
- La non-conformité s’applique à une étude ou à un nombre limité d’études, sans que le système d’organisation et de fonctionnement de l’installation d’essai soit remis en cause (non conformité ponctuelle, l’installation n’est pas classée "C").
Dans ce cas, seule la conformité BPL de l’étude ou du nombre limité d’études concernées n’est plus garantie. - La non-conformité remet en cause l’ensemble des activités de l’installation d’essai (non-conformité de système, classement "C ").
La conformité aux BPL de l’ensemble ou d’une part importante des études réalisées n’est plus garantie.
Autres modes de déclenchement d’une inspection
Des inspections peuvent être réalisées en dehors du programme régulier de vérification du respect des BPL, à la demande des autorités compétentes françaises (directions de l’ANSM en charge de l’évaluation des médicaments et des produits de santé) ou d’Etats membres de l’Union européenne ou du groupe de travail sur les BPL de l’OCDE .Il s’agit le plus souvent d’inspections spécifiques, portant sur une ou plusieurs études soumises à réglementation. Le champ de l’inspection est alors orienté vers un examen spécifique de cette ou de ces études.
Une inspection d’installation d’essai régulièrement inscrite dans le programme d’inspection de l’ANSM peut être anticipée :
- si des modifications substantielles sont apparues depuis la dernière inspection
- ou si les résultats de l’inspection précédente ne sont pas complètement satisfaisants (respect partiel des BPL, conclusion "B" ou non-conformité, conclusion "C").
Gestion des dossiers de suivi du respect des BPL
Le suivi des installations d’essai soumises à inspection par l’ANSM est formalisé de deux manières :- Une liste des inspections réalisées et de leur résultat sur les installations d’essai françaises est régulièrement mise à jour et publiée sur le site internet de l’ANSM.
Afin que la conformité réglementaire des études puisse être prise en considération, cette liste est mise à la disposition des directions en charge de l'évaluation scientifique des dossiers constitués pour le médicament à usage humain ou les produits cosmétiques ou de tatouage. - Un rapport annuel du respect des BPL en France, défini réglementairement, est transmis à la Commission européenne et au secrétariat du groupe de travail sur les BPL de l’OCDE. Ce rapport comprend notamment la liste des installations d’essai du programme d’inspection, la date à laquelle les inspections ont été réalisées ainsi que la conclusion de l’inspection sur le degré de conformité de l’installation aux BPL.
Contact :
Direction de l’inspection
ANSM
143/147 bd Anatole France
93285 Saint-Denis CEDEX
Tel :+33 (0)1 55 87 37 14 - Secrétariat du du pôle d’inspection des essais et de la vigilance
Email : BPL@ansm.sante.fr - Pour toute question relative aux BPL.
L'ANSM a rédigé un avis aux opérateurs concernant les modalités de validation des méthodes alternatives utilisées dans le cadre des tests de sécurité précliniques BPL pour les produits cosmétiques. Ce document a pour objectif de préciser les attentes en matière de requis pour la validation des méthodes en fonction des études réalisées et de leur adéquation ou non avec des lignes directrices officielles.
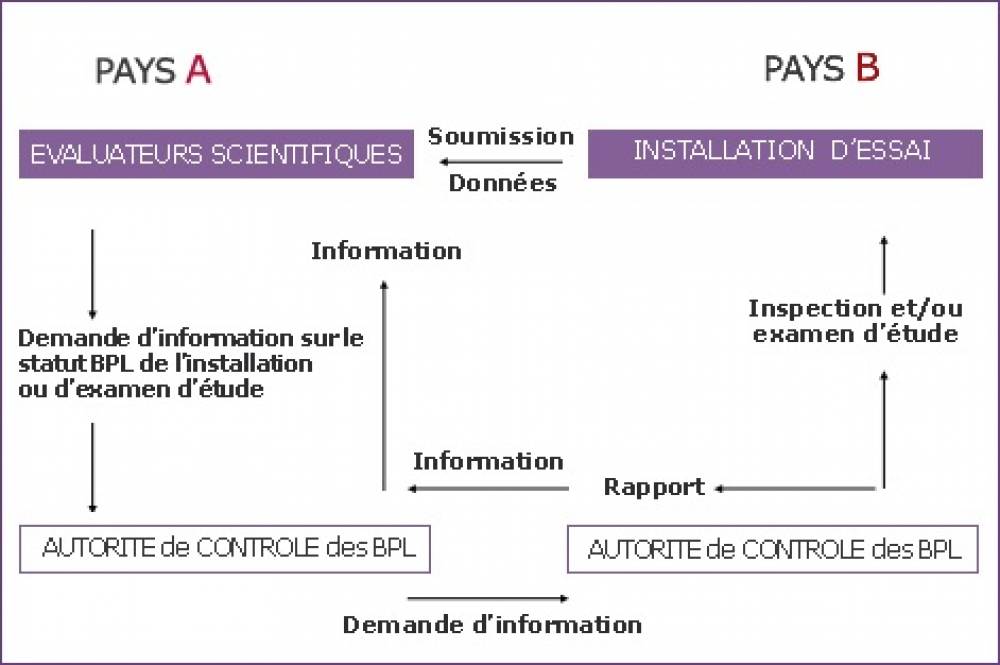
Accords de Reconnaissance Mutuelle (ARM) - Acceptation Mutuelle des données (AMD ou MAD pour Mutual Acceptance of Data) des études BPL
Les études déclarées conformes aux BPL réalisées sur le territoire d’un Etat membre de l’Union européenne ou d’un pays membre du groupe de travail sur les BPL de l’OCDE sont reconnues par les autres Etats/pays membres.Le processus de reconnaissance mutuelle est basé sur l’existence de programmes nationaux de vérification des installations d’essai déclarant réaliser des études conformément aux principes de BPL. Les autorités de contrôle des BPL constituées dans chaque Etat/pays membre disposent de l’ensemble des rapports annuels cités plus haut.
De surcroît, chaque autorité de contrôle des BPL peut demander la réalisation d’inspection ou d’examen d’études par l’autorité de contrôle des BPL d’un autre Etat/pays membre. L’inspection peut être réalisée en présence d’inspecteur(s) de l’Etat/pays demandeur. Les résultats de l’inspection sont communiqués au pays demandeur et sont également intégrés au rapport annuel précédemment évoqué.
Par ailleurs, les études non cliniques relevant du domaine des BPL soumises dans les dossiers de demande d’AMM du médicament à usage humain doivent être évaluées pour leur degré de conformité aux BPL.
Lorsque l’ANSM est rapporteur ou co-rapporteur de ces dossiers déposés en procédure centralisée, les inspecteurs en charge des BPL évaluent la conformité aux BPL des études soumises.
Lorsque l’ANSM est rapporteur ou co-rapporteur de ces dossiers déposés en procédure centralisée, les inspecteurs en charge des BPL évaluent la conformité aux BPL des études soumises.