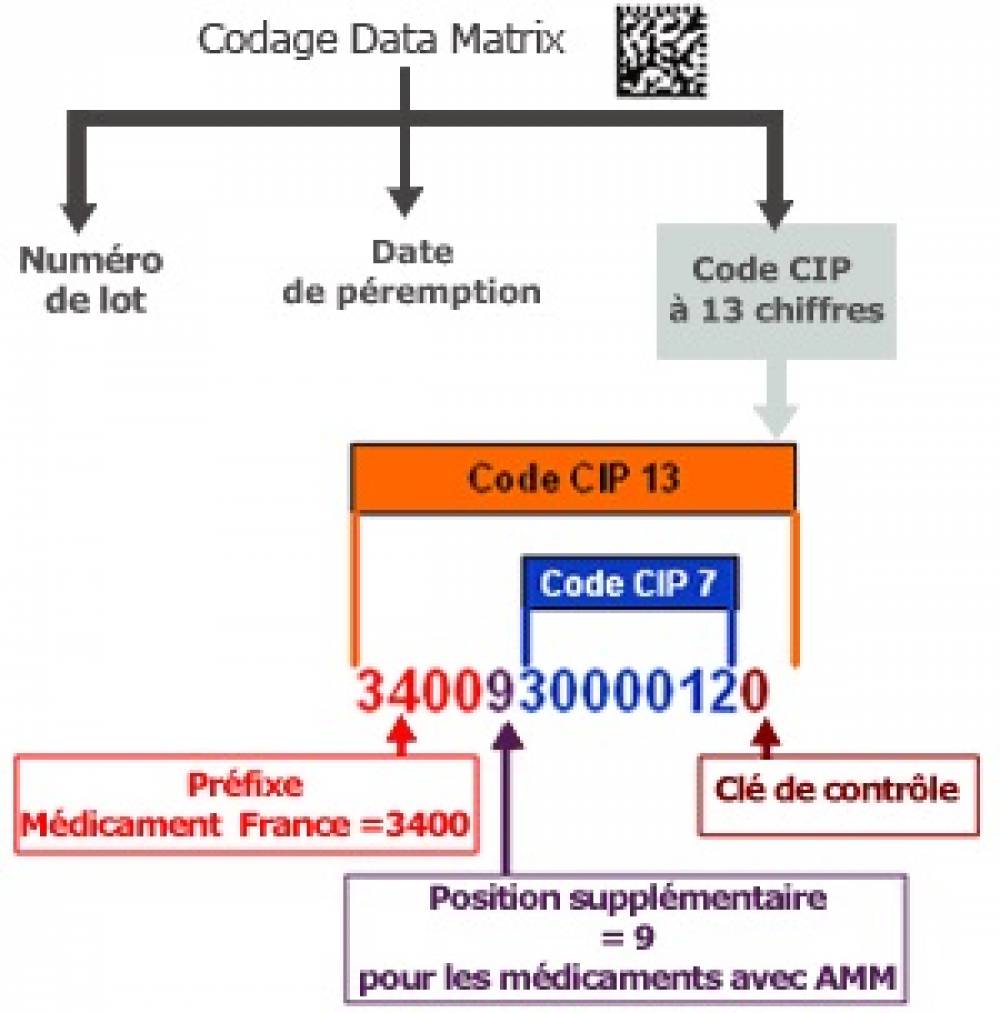
Codification
Chaque présentation d'une spécialité pharmaceutique est identifiée par un code dit "code CIP " (Code Identifiant de Présentation).Une présentation (et une seule) est définie par les éléments suivants :
- sa dénomination
- sa forme pharmaceutique
- son dosage
- son conditionnement et la contenance de son conditionnement
Depuis le 1er janvier 2009 le code identifiant de présentation (code CIP) à 7 chiffres est remplacé par un code à 13 chiffres.
La révision de la syntaxe de ce code s'avérait nécessaire en raison de :
(application des dispositions de l’article R. 5124-58 du CSP et de l’article 6 du décret n°2008-834 du 22 août 2008 relatif aux établissements pharmaceutiques et à l’importation de médicaments à usage humain)
La révision de la syntaxe de ce code s'avérait nécessaire en raison de :
- la saturation prévisible de la nomenclature CIP en 7 chiffres
- l'évolution réglementaire concernant la traçabilité au numéro de lot, l'inclusion de la date de péremption et du numéro de lot dans un marquage apposé sur les conditionnements
Traçabilité des médicaments au numéro de lot (entrées et sorties)
A la suite de dysfonctionnements dans le circuit pharmaceutique ayant conduit à la distribution de lots de médicaments retirés du marché à des officines, l’ANSM rappelle à l’ensemble des acteurs du circuit pharmaceutique leurs obligations en matière de traçabilité.(application des dispositions de l’article R. 5124-58 du CSP et de l’article 6 du décret n°2008-834 du 22 août 2008 relatif aux établissements pharmaceutiques et à l’importation de médicaments à usage humain)
Information importante
La mise en place de la traçabilité des médicaments au numéro de lot (entrées et sorties) est obligatoire depuis le 1er janvier 2011.
Tétéchargez le rappel aux exploitants sur leurs obligations en matière de traçabilité ci-dessous
Tétéchargez le rappel aux exploitants sur leurs obligations en matière de traçabilité ci-dessous
Tableaux de correspondance (annexe de la décision)
L'ensemble des fichiers mis à disposition ci-après pour consultation ou téléchargement contiennent la totalité des présentations actives de spécialités pharmaceutiques ayant une AMM active en février 2007.Ces spécialités sont recensées par ordre alphabétique de leur dénomination.
Dans chaque fichier, le tableau contient pour chaque présentation :
- Le code CIS identifiant la spécialité
- La dénomination de la spécialité
- Le code CIP à 7 chiffres identifiant la présentation
- Le code CIP à 13 chiffres dérivant du précédent
- Le nom de la présentation
- Le nom (forme courte) du laboratoire titulaire de l'AMM