PUBLIÉ LE 17/07/2025
- MIS À JOUR LE 18/11/2025
Arrêt de commercialisation de Cynomel : Thybon 20 Henning prendra le relais
Actualisation du 18/11/2025Une étiquette en français alertant sur un risque d’erreurs médicamenteuses était jusqu’à maintenant apposée sur les sachets de Thybon remis aux patients par les pharmaciens, en attendant de pouvoir l’apposer sur les boites directement.À partir de mi-novembre 2025, une étiquette « Risque d’erreurs médicamenteuses » est apposée directement sur les nouvelles boîtes de Thybon pour rappeler :
 |
Actualisation du 26/09/2025Nous rappelons que Cynomel (liothyronine sodique) ne sera plus commercialisé à partir du 31 octobre 2025. Pour assurer la continuité de traitement des patients, le laboratoire Sanofi Winthrop Industrie importe d’Allemagne Thybon 20 Henning (liothyronine chlorhydrate), que nous avons identifié comme alternative à Cynomel.Les premières boîtes de Thybon 20 Henning seront disponibles progressivement en pharmacie à compter du 7 octobre 2025. |
Le laboratoire Sanofi Winthrop Industrie a informé l’ANSM de l’arrêt de la commercialisation de Cynomel (liothyronine sodique) à compter du 31 octobre 2025. Pour assurer la continuité de traitement des patients, des importations de Thybon 20 Henning (liothyronine chlorhydrate) sont organisées par le laboratoire.
Cynomel 0,025 mg, comprimé sécable est utilisé chez l'adulte et l'enfant de plus de 6 ans pour traiter les hypothyroïdies, certains goitres et nodules.Une alternative identifiée à court et à plus long terme
En anticipation, nous avons identifié une alternative au Cynomel : Thybon 20 Henning (liothyronine chlorhydrate), disposant d’une autorisation de mise sur le marché (AMM) en Allemagne depuis plus de 25 ans. Le laboratoire Sanofi s’est engagé à importer en France ce médicament.Ces importations seront effectives au moment de l’arrêt de Cynomel et seront suivies d’une demande d’AMM de Thybon en France pour assurer un accès pérenne à ce médicament, afin d’éviter aux patients des changements répétés de traitement.
Il n’y aura ainsi pas de rupture d’approvisionnement entre la fin de distribution de Cynomel et le début de mise à disposition de Thybon.
Caractéristiques des spécialités Cynomel et Thybon 20 Henning
| Cynomel 0,025 mg | Thybon 20 µg Henning | |
| Présentation | Boîte de 30 comprimés | Boîte de 50 comprimés |
| DCI | Liothyronine sodique | Liothyronine chlorhydrate |
| Forme galénique | Comprimé quadrisécable | Comprimé bisécable avec barre de sécabilité |
| Dosage | 25 µg (0,025 mg) de liothyronine sodique équivalent à 24,18 µg de liothyronine base | 20 µg (0,020 mg) de liothyronine chlorhydrate équivalent à 18,94 µg de liothyronine base |
| Excipients | Sulfate de calcium dihydraté, gélatine (dont phénylalanine), saccharose, amidon de blé, acide stéarique, talc | Amidon prégélatinisé (maïs), amidon de maïs, cellulose microcristalline, carbonate de sodium, thiosulfate de sodium 5 H20, dioxyde de silicium hautement dispersé, huile de ricin hydrogénée |
| Site de fabrication | France | Espagne |
| Péremption | 2 ans | 2 ans |
Points d’attention
Sécabilité
Thybon 20 Henning présente une barre de sécabilité, permettant de couper le comprimé en deux, contrairement au Cynomel qui est quadrisécable.Si un ajustement de posologie plus fin est nécessaire, un avis médical, accompagné des dosages hormonaux appropriés, peut conduire à une découpe en quarts du comprimé. Il conviendra d'utiliser un coupe-comprimé, sans garantie de coupes parfaitement égales.
Grossesse
La liothyronine est contre-indiquée pendant la grossesse, en accord avec les recommandations internationales du traitement substitutif chez les femmes enceintes. La lévothyroxine doit être utilisée dans ce cas.Excipient à effet notoire
Thybon 20 Henning contient de l’huile de ricin pouvant entrainer un risque de réaction allergique chez certains patients.Recommandations
En accord avec la Société française d’endocrinologie (SFE), le Groupe de recherche sur la thyroïde (GRT) et après avis du conseil national professionnel (CNP) d’endocrinologie diabétologie nutrition et les associations de patients, nous avons établi les recommandations ci-dessous.Information à destination des patients
Si vous êtes actuellement traité(e) par Cynomel, votre médecin pourra vous prescrire Thybon 20 Henning en alternative à Cynomel. Une nouvelle ordonnance de votre médecin sera nécessaire.
Vous devez prendre ce médicament selon la posologie précisée sur l’ordonnance. Respectez-la strictement. Votre médecin vous prescrira également des dosages d’hormones thyroïdiennes (TSH, T4, T3) :
Vous devez prendre ce médicament selon la posologie précisée sur l’ordonnance. Respectez-la strictement. Votre médecin vous prescrira également des dosages d’hormones thyroïdiennes (TSH, T4, T3) :
- Systématiquement 6 à 8 semaines après le début du traitement ;
- 6 à 8 semaines après tout changement de dose au cours du traitement ;
- En cas de variation importante de votre poids ;
- En cas de signes cliniques ou de symptômes évoquant un déséquilibre thyroïdien, ou si vous avez tout autre symptôme ou ressenti inhabituel ;
- En cas de persistance et/ou d’aggravation des signes cliniques.
Information à destination des médecins
Pour les patients actuellement traités par Cynomel, le traitement pourra être poursuivi avec Thybon 20 Henning, en vous référant à la note d’information destinée aux professionnels de santé. Une nouvelle ordonnance sera nécessaire.
Un contrôle de TSH, T4 et T3 doit être réalisé afin de déterminer la dose efficace optimale :
Le suivi régulier au cours du traitement permet d’ajuster la dose pour atteindre l’objectif thérapeutique en tenant compte du ressenti du patient, selon les recommandations actualisées de la HAS dans la prise en charge de l’hypothyroïdie.
Un contrôle de TSH, T4 et T3 doit être réalisé afin de déterminer la dose efficace optimale :
- Systématiquement 6 à 8 semaines après le début du traitement ;
- 6 à 8 semaines après tout changement de dose au cours du traitement ;
- En cas de variation importante de votre poids corporel ;
- En cas de signes cliniques ou de symptômes évoquant un déséquilibre thyroïdien ou si vous avez tout autre symptôme ou ressenti inhabituel ;
- En cas de persistance et/ou d’aggravation des signes cliniques.
Le suivi régulier au cours du traitement permet d’ajuster la dose pour atteindre l’objectif thérapeutique en tenant compte du ressenti du patient, selon les recommandations actualisées de la HAS dans la prise en charge de l’hypothyroïdie.
Prévention du risque d’erreur médicamenteuse
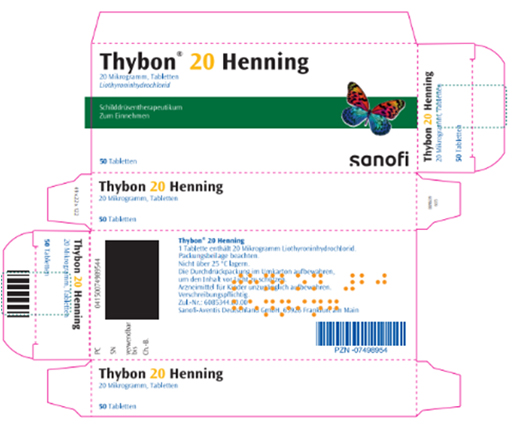
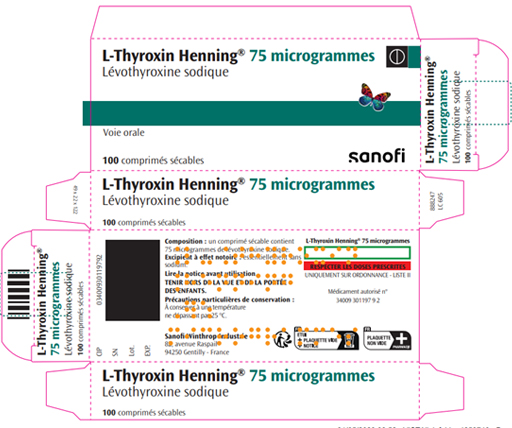
Les boîtes du médicament importé Thybon 20 Henning (liothyronine) et du médicament autorisé en France L-Thyroxin Henning (lévothyroxine), tous deux du laboratoire Sanofi, se ressemblent fortement.
Nous invitons les pharmaciens à sensibiliser les patients à ce risque de confusion notamment ceux prenant simultanément ces deux traitements.
Le conditionnement de Thybon 20 Henning est rédigé en allemand et non en français.
Afin de réduire le risque d’erreur médicamenteuse et d’éviter toute confusion notamment chez les patients prenant simultanément ces deux traitements, nous avons demandé au laboratoire :
Nous invitons les pharmaciens à sensibiliser les patients à ce risque de confusion notamment ceux prenant simultanément ces deux traitements.
Le conditionnement de Thybon 20 Henning est rédigé en allemand et non en français.
Afin de réduire le risque d’erreur médicamenteuse et d’éviter toute confusion notamment chez les patients prenant simultanément ces deux traitements, nous avons demandé au laboratoire :
- D’apposer une étiquette en français sur les sachets de Thybon remis aux patients par les pharmaciens ;
- D’intégrer dans chaque sachet de Thybon un courrier d’information en français, ainsi qu’une une note d’information destinée aux patients qui les informe sur les précautions d’usage
| Visuel Thybon 20 Henning | Visuel L-Thyroxin Henning 75 microgrammes |
 |
 |
Arrêt de commercialisation
PUBLIÉ LE 25/10/2024
- MIS À JOUR LE 20/10/2025