PUBLIÉ LE 20/09/2019
- MIS À JOUR LE 16/10/2020
Arrêt de fabrication de la pompe implantable Medtronic MiniMed (MIP) : retour sur la réunion de consultation du 12 septembre 2019
Point d'information actualisé le 20/07/2020
En vue de l’arrêt de fabrication de la pompe implantable Medtronic MiniMed 2007D (MIP), prévu au 2e semestre 2020, l’ANSM a réuni le 12 septembre 2019 l’ensemble des parties prenantes concernées afin de partager les données disponibles et d’échanger sur les perspectives à court et moyen terme pour permettre la prise en charge thérapeutique des patients.
Les représentants de patients diabétiques et des diabétologues, les sociétés Medtronic et Sanofi, la DGS, la HAS et l’ANSM ont abordé en particulier la mise à disposition du dispositif et le parcours de soins des patients.La DGS prévoit de réunir l’ensemble des parties prenantes afin de suivre les actions à mener.
Information importante
A la demande de l’EMA, un courrier a été adressé aux diabétologues poseurs de la pompe le 17 juillet, afin de les informer de l’arrêt de la commercialisation de la pompe implantable Medtronic MiniMed à la fin de l’année 2020. De ce fait, il est recommandé aux prescripteurs de ne pas implanter la pompe Minimed MMT 2007-D chez de nouveaux patients.
Le courrier aux médecins est accompagné d’une lettre, que le médecin doit remettre aux patients porteurs ou demandeurs d’informations sur cette pompe, expliquant les causes de l’arrêt de commercialisation.
Le courrier aux médecins est accompagné d’une lettre, que le médecin doit remettre aux patients porteurs ou demandeurs d’informations sur cette pompe, expliquant les causes de l’arrêt de commercialisation.
Les membres du Collectif des diabétiques implantés présents au cours de la réunion ont pu témoigner de l’amélioration à la fois de leur qualité de vie et de la prise en charge de leur maladie que la pompe MIP (voir encadré) a permis. Ils ont affirmé que la pompe MIP est vitale pour beaucoup d’entre eux. Ils ont également affirmé que les traitements par voie intrapéritonéale sont indispensables pour eux et fait part de leur espoir que la pompe MIP puisse rester disponible jusqu’à ce qu’une nouvelle technologie implantable par cette même voie prenne le relai afin de sortir de l’impasse actuelle.
Les représentants de la Fédération française des diabétiques (AFD) ont confirmé l’intérêt de la pompe MIP. Néanmoins, l’AFD a souligné le caractère ancien de la technologie MIP et appelle de ses vœux la poursuite de l’innovation.
La société Medtronic a confirmé son intention de mettre un terme à la fabrication de la pompe MIP et a assuré rechercher activement des alternatives potentielles pérennes pour la fabrication de pompes implantables nouvelle génération. Elle a pris l’engagement de garantir la disponibilité des consommables nécessaires au bon fonctionnement des pompes implantées jusqu’à la fin de leur utilisation par les patients.
La société Sanofi, qui produit une insuline spécifique utilisée exclusivement dans la pompe MIP, a garanti la disponibilité de cette insuline tant que les patients en auront besoin.
Les diabétologues présents ont indiqué que les systèmes permettant l’injection d’insuline par voie intrapéritonéale représentent une technologie d’avenir qu’il convient de ne pas abandonner, en particulier pour les patients, peu nombreux, qui sont résistants ou intolérants aux autres traitements (hypoglycémie sévère, intolérance à l’insuline sous cutanée, diabète instable). La disponibilité des systèmes en boucle fermée et des greffes d’îlots pancréatiques ne permet pas, à ce jour, de les considérer comme des alternatives documentées aux pompes implantées faute de preuves.
A ce stade, aucun essai clinique n’a comparé les pompes à insuline implantables à la greffe d’ilots ou aux systèmes en boucle fermée chez les patients souffrant d’hypoglycémie sévère. Les diabétologues ont néanmoins précisé que 2 essais cliniques testant des systèmes externes en boucle fermée sont en cours chez des patients souffrant d’hypoglycémie sévère.
L’ANSM est attentive aux difficultés rencontrées par les patients porteurs de la pompe MIP. Elle veillera au respect des engagements pris par Medtronic et Sanofi, et invite d’ores-et-déjà les professionnels de santé à élaborer des protocoles de prise en charge des patients concernés.
Elle rappelle qu’elle n’a pas le pouvoir d’obliger les industriels à continuer la fabrication des produits. Néanmoins l’ANSM encourage l’innovation. Si une alternative émergeait, elle prendrait toute disposition pour en faciliter la mise à disposition, tant que la sécurité du patient est assurée.
Afin de suivre les actions à mener, tant auprès des industriels que des professionnels de santé, des établissements et des patients, la DGS prévoit de réunir l’ensemble des parties prenantes dans le courant du mois de novembre.
Les représentants de la Fédération française des diabétiques (AFD) ont confirmé l’intérêt de la pompe MIP. Néanmoins, l’AFD a souligné le caractère ancien de la technologie MIP et appelle de ses vœux la poursuite de l’innovation.
La société Medtronic a confirmé son intention de mettre un terme à la fabrication de la pompe MIP et a assuré rechercher activement des alternatives potentielles pérennes pour la fabrication de pompes implantables nouvelle génération. Elle a pris l’engagement de garantir la disponibilité des consommables nécessaires au bon fonctionnement des pompes implantées jusqu’à la fin de leur utilisation par les patients.
La société Sanofi, qui produit une insuline spécifique utilisée exclusivement dans la pompe MIP, a garanti la disponibilité de cette insuline tant que les patients en auront besoin.
Les diabétologues présents ont indiqué que les systèmes permettant l’injection d’insuline par voie intrapéritonéale représentent une technologie d’avenir qu’il convient de ne pas abandonner, en particulier pour les patients, peu nombreux, qui sont résistants ou intolérants aux autres traitements (hypoglycémie sévère, intolérance à l’insuline sous cutanée, diabète instable). La disponibilité des systèmes en boucle fermée et des greffes d’îlots pancréatiques ne permet pas, à ce jour, de les considérer comme des alternatives documentées aux pompes implantées faute de preuves.
A ce stade, aucun essai clinique n’a comparé les pompes à insuline implantables à la greffe d’ilots ou aux systèmes en boucle fermée chez les patients souffrant d’hypoglycémie sévère. Les diabétologues ont néanmoins précisé que 2 essais cliniques testant des systèmes externes en boucle fermée sont en cours chez des patients souffrant d’hypoglycémie sévère.
L’ANSM est attentive aux difficultés rencontrées par les patients porteurs de la pompe MIP. Elle veillera au respect des engagements pris par Medtronic et Sanofi, et invite d’ores-et-déjà les professionnels de santé à élaborer des protocoles de prise en charge des patients concernés.
Elle rappelle qu’elle n’a pas le pouvoir d’obliger les industriels à continuer la fabrication des produits. Néanmoins l’ANSM encourage l’innovation. Si une alternative émergeait, elle prendrait toute disposition pour en faciliter la mise à disposition, tant que la sécurité du patient est assurée.
Afin de suivre les actions à mener, tant auprès des industriels que des professionnels de santé, des établissements et des patients, la DGS prévoit de réunir l’ensemble des parties prenantes dans le courant du mois de novembre.
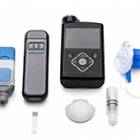
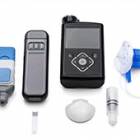
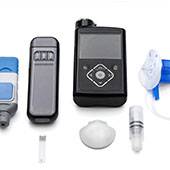
Pompe implantable MiniMed 2007D (MIP)