PUBLIÉ LE 23/10/2024
- MIS À JOUR LE 15/01/2026
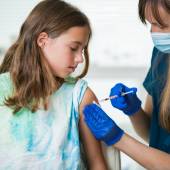
Campagne vaccinale contre les infections à papillomavirus humains (HPV) : les dernières données confirment de nouveau le profil de sécurité du vaccin Gardasil 9
Dans le cadre de la surveillance renforcée du vaccin Gardasil 9 utilisé pour la campagne de vaccination dans les collèges contre les HPV, nous publions une deuxième synthèse périodique des cas de pharmacovigilance déclarés après l’administration du vaccin, entre le 16 janvier et le 15 juin 2024. Elle fait suite à la synthèse d’avril dernier.
Nous avons mis en place une surveillance continue en lien avec le réseau français des centres régionaux de pharmacovigilance (CRPV). L’analyse des cas ne montre aucun nouveau signal de sécurité avec ce vaccin. Les effets déclarés sont en majorité, comme dans la première synthèse, des effets post-vaccinaux connus et non graves de Gardasil 9. Les données disponibles à ce jour confirment que le profil de sécurité du vaccin est bien établi.
La nouvelle campagne de vaccination scolaire 2024/2025 a débuté dans les collèges : nous rappelons aux vaccinateurs l’importance de la surveillance post-vaccination et des conduites à tenir, pour prévenir des risques de chutes et de blessures suite à un malaise et en raison du très rare risque de réactions allergiques graves.
De janvier à juin 2024, 57 cas d’effets indésirables ont été déclarés à la suite d’une vaccination contre les cancers HPV dans le cadre de la campagne vaccinale dans les collèges.Les effets post-vaccinaux connus et non graves de Gardasil 9 sont principalement à type de réactions au site d’injection du vaccin (rougeurs, douleurs et/ou inflammation), de céphalées, de sensations de vertige, de troubles gastro-intestinaux, de fièvre ou de fatigue. Tous ces effets peuvent apparaître rapidement après la vaccination et durent peu de temps.
Durant la période de janvier à juin 2024, aucun nouveau signal de sécurité n’a été identifié : cela signifie qu’il n’y a pas de nouveau risque identifié en lien avec le vaccin.
Nous publierons prochainement le rapport complet de pharmacovigilance qui analysera l’ensemble des données incluant cette première année de campagne de vaccination dans les collèges.
Pour l’année 2024-2025, le dispositif de surveillance renforcée pour la nouvelle campagne de vaccination est maintenu.
Rappel de la surveillance post-vaccination de 15 minutes
Comme indiqué dans le résumé des caractéristiques du produit et la notice du vaccin Gardasil 9, en raison d’un risque de malaise et de syncope parfois sans symptômes pré-syncopaux, en particulier chez les adolescents, les personnes recevant le vaccin doivent être surveillées pendant 15 minutes après l'injection du vaccin.
Cet effet indésirable, peu fréquent et rapidement résolutif, peut parfois s’accompagner de tremblements ou raideurs.
Par conséquent :
Cet effet indésirable, peu fréquent et rapidement résolutif, peut parfois s’accompagner de tremblements ou raideurs.
Par conséquent :
- Il est recommandé d’interroger l'enfant sur une potentielle inquiétude ou anxiété sur cette vaccination et lui apporter les éléments pour le rassurer si nécessaire ;
- Bien indiquer à l’enfant l’importance de signaler rapidement s’il ne se sent pas bien après la vaccination ;
- La surveillance attentive de l’adolescent est indispensable pendant la surveillance post vaccinale ;
- La prévention des blessures en cas de chute est indispensable pendant la surveillance : l’adolescent doit rester préférentiellement allongé (sur des tapis de sol ou couverture si ces derniers sont disponibles) ou assis par terre adossé à un mur dans un espace dégagé.
Qu’est-ce qu’un cas déclaré ?
Un “cas déclaré" correspond à une personne vaccinée chez laquelle la survenue d’un ou de plusieurs événements indésirables après l’administration d’un vaccin a donné lieu à une déclaration de pharmacovigilance. “Cas déclaré” ne signifie pas forcément que l’événement est imputable au vaccin ; pour cela, il doit faire l'objet d'une expertise médicale. Cette expertise va déterminer si l’événement peut être lié au médicament, au regard de la chronologie d’apparition des symptômes, du mécanisme d’action du médicament, des effets connus et rapportés, y compris dans la littérature.
Les cas notifiés sont classés selon leur gravité (grave ou non grave) et leur caractère attendu ou non (attendu si la description figure dans le résumé des caractéristiques du produit et la notice, inattendu si elle ne l’est pas). Si un cas d’effet indésirable est susceptible de constituer un signal potentiel de sécurité, il est immédiatement porté à la connaissance de l’ANSM.
Les cas notifiés sont classés selon leur gravité (grave ou non grave) et leur caractère attendu ou non (attendu si la description figure dans le résumé des caractéristiques du produit et la notice, inattendu si elle ne l’est pas). Si un cas d’effet indésirable est susceptible de constituer un signal potentiel de sécurité, il est immédiatement porté à la connaissance de l’ANSM.
