PUBLIÉ LE 05/09/2024
- MIS À JOUR LE 16/10/2025
Réévaluation du pictogramme grossesse sur les boîtes de médicaments : lancement d’une consultation publique
Le comité scientifique temporaire (CST) « Réévaluation du pictogramme grossesse figurant sur le conditionnement extérieur des médicaments tératogènes ou fœtotoxiques » propose, à l’issue de ses travaux initiés en janvier 2023, une évolution de ce dispositif d’information. Les propositions de modifications concernent aussi bien les critères d’apposition que le visuel du dispositif.
Nous lançons une consultation publique sur ces propositions et invitons toutes les personnes intéressées à nous faire part de leurs remarques d’ici le 17 octobre. Elles enrichiront notre réflexion et nous permettront d’asseoir notre position sur les avis les plus larges possible.
En France depuis 2017, des pictogrammes « femme enceinte » figurent sur les boîtes des médicaments tératogènes ou foetotoxiques. La Direction générale de la santé nous a demandé d’engager l’évaluation de ce dispositif après plusieurs années d’existence, et proposer si nécessaire une évolution pour améliorer encore la sécurité des femmes et de leurs futurs enfants.
Afin de mener à bien cette mission, l’ANSM a rassemblé en janvier 2023 un comité scientifique temporaire (CST) pluridisciplinaire pour l’accompagner dans la réalisation de ce projet.
À l’issue de ses travaux, le CST propose les évolutions suivantes :
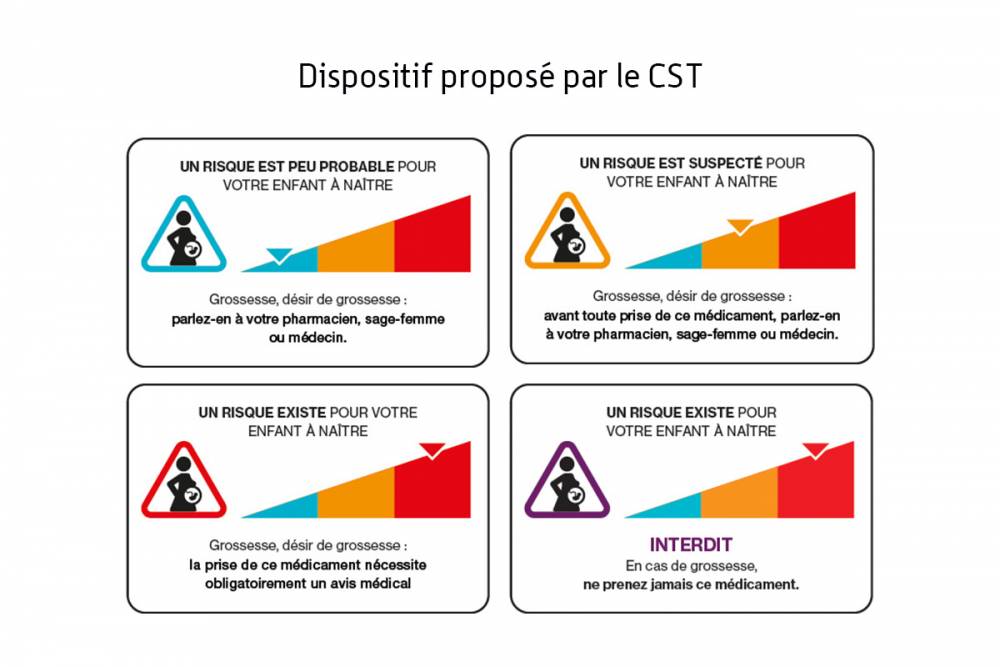
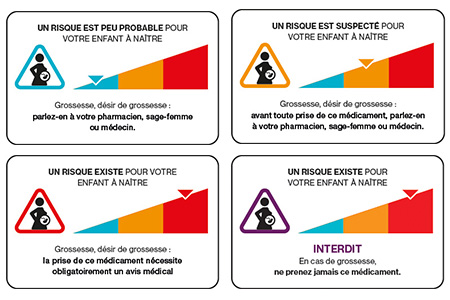
- Le nouveau dispositif doit informer de quatre risques et non seulement deux : le risque tératogène et le risque fœtotoxique, mais aussi le risque de fausse couche et le risque de troubles neurodéveloppementaux ;
- Tous les médicaments doivent intégrer ce dispositif ;
- Le dispositif d’information doit se présenter sous la forme d’un visuel associé à un texte renseignant sur le risque et sur une conduite à adopter ;
- Ce visuel, ce texte et cette conduite à tenir sont accompagnés d’une jauge colorée qui constitue une échelle de connaissance du risque pour le déroulement de la grossesse et pour l’enfant à naître. Elle permet à chacun de situer le niveau de risque du médicament ;
- Un dispositif complémentaire spécifique pour les médicaments qui ne doivent jamais être pris pendant la grossesse est également proposé.
Quelles sont les prochaines étapes ?
Les propositions élaborées par le CST sont mises en consultation publique pour une durée de 6 semaines (date limite pour répondre : 17 octobre 2024 au soir). Si vous souhaitez nous partager votre avis, suivez le lien ci-dessous.
À l’issue de cette consultation, nous rédigerons une proposition et la transmettrons à la Direction générale de la santé qui décidera d’une évolution ou non du dispositif.
Quelles sont les principales différences entre le dispositif actuel et le dispositif proposé par le CST ?
Actuel |
Futur |
Quels sont les risques pour l’enfant à naître pris en compte ? |
|
2 risques
|
4 risques
|
Quels sont les médicaments concernés par l’apposition du dispositif d’information ? |
|
| Les médicaments disposant d’une AMM en France et qui comportent dans leur résumé des caractéristiques du produit (RCP) des informations indiquant qu’ils sont tératogènes ou fœtotoxiques d’après les études animales ou les données observées chez l’être humain. Ainsi, un pictogramme est apposé si un risque d’effet est identifié chez l’animal et ce, même si des données chez l’être humain sont rassurantes, et inversement. |
Tous les médicaments disposant d’une AMM en France. Pour les 4 risques (tératogène, fœtotoxique, fausse-couche et troubles neurodéveloppementaux), le médicament est classé sur une échelle de connaissance de risque selon les informations présentes dans le résumé des caractéristiques du produit (RCP) d’après des données chez l’être humain :
|
Quels sont les éléments du dispositif d’information ? |
|
 |
 |
Qui décide de l’apposition du pictogramme ? |
|
| L’industriel titulaire de l’AMM. | L’industriel titulaire de l'AMM propose et l’ANSM valide. |
Rappel sur les travaux conduits par le CST
Le comité scientifique temporaire était composé de 18 membres choisis en raison de leurs compétences dans différentes disciplines en lien avec la santé et la grossesse, ainsi que de leur expertise relative aux patients et usagers du système de santé.Le premier objectif du CST a été de réaliser un état des lieux du dispositif actuel. Dans le cadre de cet état des lieux, plusieurs outils ont été mobilisés :
- Consultation de parties prenantes au cours d’auditions publiques ;
- Mise en place d’un appel à contributions écrites ;
- Réalisation d’une enquête d’opinion auprès de femmes en âge d’avoir des enfants.
Celles-ci ont été testées par un institut de sondages auprès de groupes de personnes d’horizons très différents. Les résultats ont permis d’affiner les propositions du CST et ont contribué à la finalisation de son avis.