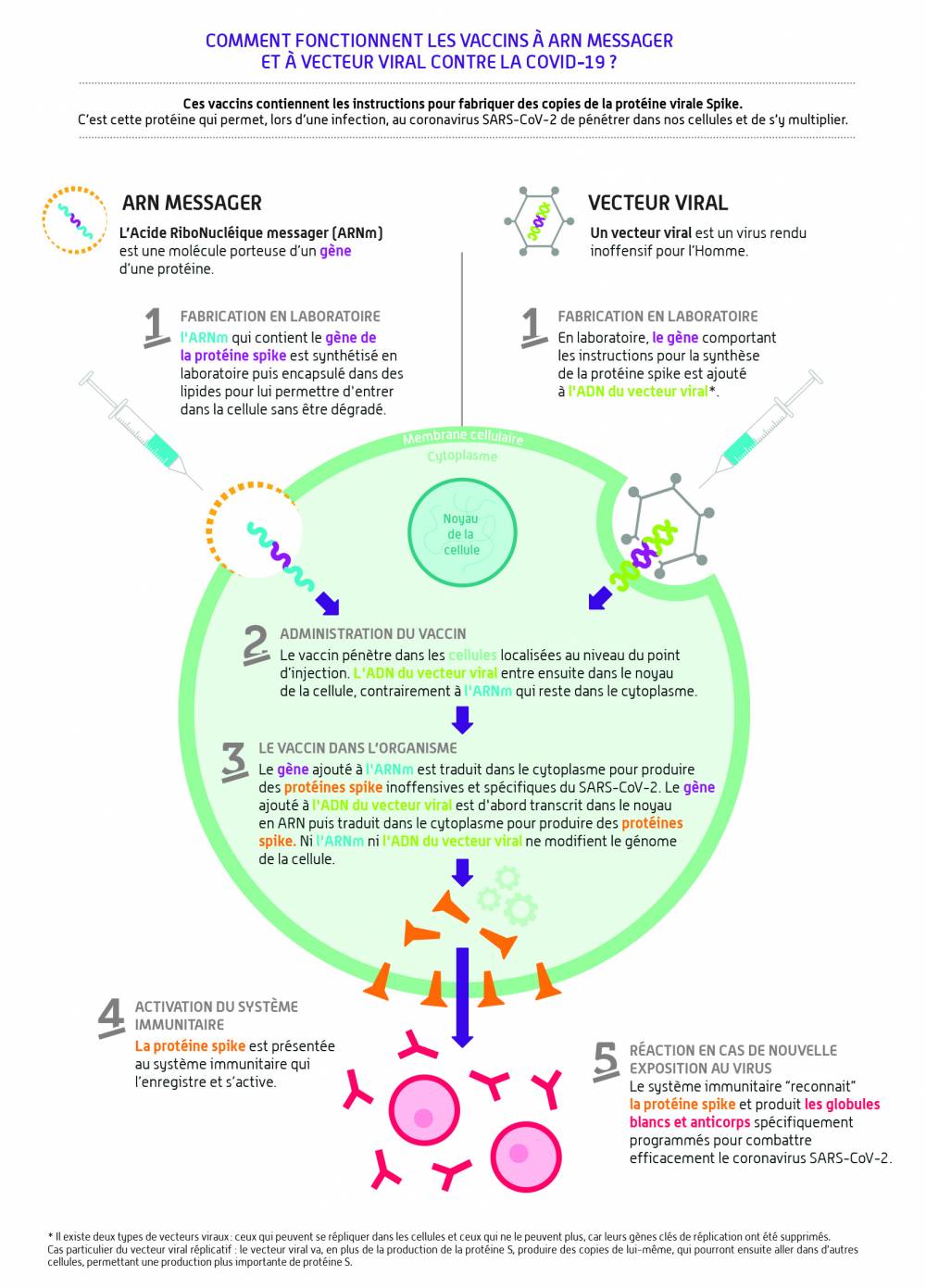
L’essentiel
Dans le cadre de la campagne nationale de vaccination contre le Covid-19, qui a débuté le 27 décembre 2020, nous avons mis en place un dispositif spécifique de surveillance renforcée en lien avec le réseau français des centres régionaux de pharmacovigilance (CRPV) et le groupement d’intérêt scientifique Epi-Phare (ANSM / Assurance Maladie).Ce dispositif constituait un enjeu majeur de santé publique pour assurer le suivi étroit des nouveaux vaccins disponibles. Il a permis de garantir leur efficacité dans la population vaccinée et d’identifier les effets indésirables qui n’auraient pas été observés lors des essais cliniques.
Plus de quatre ans après le lancement de la campagne et disposant d’un recul de plus de 152 millions d’injections en France (en février 2024), la surveillance que nous avons mise en place ainsi que les données internationales confirment que les vaccins contre le Covid-19 sont sûrs et efficaces, y compris contre les variants récents.
Dans ce contexte, notre dispositif de surveillance renforcée évolue. Ces vaccins sont désormais surveillés à travers une analyse en continu des cas marquants par les experts des centres régionaux de pharmacovigilance (CRPV) et de l’agence. La surveillance de l’ANSM continue également, en s’appuyant à présent sur son Comité scientifique permanent « pharmaco-surveillance et bon usage » pour l’analyse collégiale des éventuels nouveaux signaux de sécurité détectés, à la place du comité de suivi sur les vaccins contre le Covid-19.
Si un signal de sécurité est validé, des mesures adaptées à la nature et au niveau du risque seront mises en place, en lien avec l’Agence européenne du médicament (EMA), afin de prévenir ou réduire la probabilité de survenue du risque chez les personnes vaccinées.
Les études de pharmaco-épidémiologie conduites par Epi-Phare sur l’ensemble de la population française attestent de l’impact majeur de la vaccination pour protéger des formes graves de la maladie. Ces études ont permis de confirmer l’efficacité observée dans les essais cliniques qui avaient inclus des dizaines de milliers de personnes. Des études internationales témoignent également de leur efficacité.
La surveillance que nous avons mise en place montre que la majorité des effets indésirables déclarés ne sont pas graves et avaient été observés lors des essais cliniques. Elle a aussi permis d’identifier des effets indésirables rares, tels que les myocardites avec les vaccins à ARNm (Comirnaty de Pfizer/BioNTech et Spikevac de Moderna) et les thromboses atypiques avec les vaccins à vecteur adénoviral (Vaxzervia d’AstraZeneca et Jcovden de Janssen). Les nouveaux effets indésirables identifiés grâce à notre surveillance ne remettent pas en cause le profil de sécurité des vaccins.
En 2025, l’EMA a recommandé de mettre à jour ces vaccins pour cibler le nouveau variant LP.8.1 du Covid-19 à l’occasion de la campagne de vaccination 2025/2026.
Menée du 14 octobre (9 septembre pour Mayotte) 2025 au 31 janvier 2026, la campagne nationale de vaccination en France utilise des vaccins monovalents Comirnaty adaptés au variant LP.8.1 en circulation :
- Comirnaty LP.8.1 (30μg/dose) pour adulte utilisé chez les personnes de 12 ans et plus ;
- Comirnaty LP.8.1 (10μg/dose) pédiatrique pour les enfants de 5 à 11 ans ;
- Comirnaty LP.8.1 (3μg/dose) pédiatrique pour les enfants de 6 mois à 4 ans.