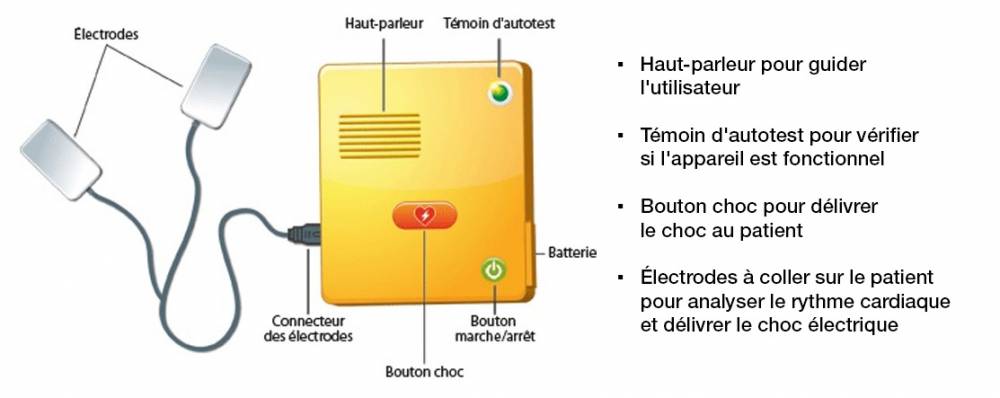
Il existe deux types de défibrillateurs automatisés externes (DAE) :
- Les défibrillateurs semi-automatiques : le choc est délivré lorsque l’utilisateur appuie sur un bouton, à la demande de l’appareil ;
- Les défibrillateurs entièrement automatiques : le choc est délivré directement par l’appareil, sans intervention de l’utilisateur.
Un DAE est un dispositif médical : avant sa mise sur le marché, il doit disposer d’un certificat de conformité valide, délivré par un organisme notifié, ainsi que du marquage CE associé. Tout détenteur d’un DAE peut se rapprocher de son fournisseur pour obtenir ces informations.
Il est possible de s’initier à l’utilisation d’un DAE dans le cadre de formations aux gestes de premiers secours, dispensées par des organismes spécialisés. Ces formations peuvent faciliter leur utilisation en situation d’urgence et de stress.
Les exploitants ou personnes en charge d’un DAE au sein d'un établissement peuvent se rapprocher du fabricant ou de leur fournisseur afin de connaître les modalités de formation.
Une fois que le DAE a réalisé l’analyse, si un choc est recommandé, un appareil semi-automatique demande d’appuyer sur un bouton pour délivrer le choc. En revanche, un appareil entièrement automatique délivre le choc sans action de la part de l'utilisateur.
Par précaution, quel que soit le type d’appareil, l'utilisateur ne doit pas toucher le patient pendant que le choc est délivré pour ne pas recevoir de décharge électrique.
Qui peut utiliser un DAE ?
Toute personne, médecin ou non, est habilitée à l’utiliser (décret n°2007-705 du 4 mai 2007).Il est possible de s’initier à l’utilisation d’un DAE dans le cadre de formations aux gestes de premiers secours, dispensées par des organismes spécialisés. Ces formations peuvent faciliter leur utilisation en situation d’urgence et de stress.
Les exploitants ou personnes en charge d’un DAE au sein d'un établissement peuvent se rapprocher du fabricant ou de leur fournisseur afin de connaître les modalités de formation.
Comment utiliser un DAE ?
Une fois allumé, l’appareil émet des instructions vocales et visuelles guidant l'utilisateur sur la conduite à tenir et les gestes à effectuer. L’appareil indique par exemple : « Appeler les secours », « Coller les électrodes » ou encore « Procéder au massage cardiaque ». Il demande d’arrêter le massage pendant l'analyse du rythme cardiaque afin d’éviter de perturber l’analyse.Une fois que le DAE a réalisé l’analyse, si un choc est recommandé, un appareil semi-automatique demande d’appuyer sur un bouton pour délivrer le choc. En revanche, un appareil entièrement automatique délivre le choc sans action de la part de l'utilisateur.
Par précaution, quel que soit le type d’appareil, l'utilisateur ne doit pas toucher le patient pendant que le choc est délivré pour ne pas recevoir de décharge électrique.
Attention
Après utilisation, l’exploitant du DAE doit remplacer les électrodes au plus tôt et vérifier l’état de la batterie.
Un remplacement de la batterie peut être nécessaire pour certains appareils.
Il est recommandé de se référer à la notice d’utilisation fournie avec le dispositif.
Un remplacement de la batterie peut être nécessaire pour certains appareils.
Il est recommandé de se référer à la notice d’utilisation fournie avec le dispositif.
En savoir plus sur la réglementation des DAE
Les dispositifs médicaux étaient régis depuis juin 1993 par la directive 93/42/CEE relative aux dispositifs médicaux. En avril 2017, le législateur européen a adopté le règlement 2017/745 relatif aux dispositifs médicaux, entré en application le 26 mai 2021. Ce règlement détaille et renforce de nombreuses exigences relatives aux dispositifs médicaux, aux opérateurs économiques (fabricant, mandataire, importateur, distributeur) et aux organismes notifiés impliqués dans l’évaluation de la conformité des dispositifs, permettant d’assurer que seuls les dispositifs répondant à des exigences générales en matière de sécurité et de performances soient mis sur le marché et utilisés.
L’entrée en application du règlement 2017/745 a notamment modifié la classification des DAE : ils appartenaient jusqu'alors à la classe IIb (classe de risque potentiel élevé) et relèvent désormais de la classe III (classe de risque la plus élevée).
Le règlement 2017/745 a institué une période transitoire (article 120), permettant ainsi à tout fabricant de dispositifs médicaux qui commercialise des dispositifs médicaux de classe III de pouvoir continuer à les mettre sur le marché jusqu’au 31 décembre 2027, en application du certificat délivré au titre de la directive 93/42/CEE, sous réserve que les conditions listées au paragraphe 3 quater de l’article 120 soient remplies.
Les dispositifs concernés doivent notamment avoir fait l’objet d’une demande formelle d’évaluation de la conformité auprès d’un organisme notifié par le fabricant avant le 26 mai 2024 et un accord écrit à cette fin doit avoir été signé entre l’organisme notifié et le fabricant avant le 26 septembre 2024.
Ainsi, les DAE couverts par un certificat CE au titre de la directive 93/42/CEE peuvent continuer :
L’entrée en application du règlement 2017/745 a notamment modifié la classification des DAE : ils appartenaient jusqu'alors à la classe IIb (classe de risque potentiel élevé) et relèvent désormais de la classe III (classe de risque la plus élevée).
Le règlement 2017/745 a institué une période transitoire (article 120), permettant ainsi à tout fabricant de dispositifs médicaux qui commercialise des dispositifs médicaux de classe III de pouvoir continuer à les mettre sur le marché jusqu’au 31 décembre 2027, en application du certificat délivré au titre de la directive 93/42/CEE, sous réserve que les conditions listées au paragraphe 3 quater de l’article 120 soient remplies.
Les dispositifs concernés doivent notamment avoir fait l’objet d’une demande formelle d’évaluation de la conformité auprès d’un organisme notifié par le fabricant avant le 26 mai 2024 et un accord écrit à cette fin doit avoir été signé entre l’organisme notifié et le fabricant avant le 26 septembre 2024.
Ainsi, les DAE couverts par un certificat CE au titre de la directive 93/42/CEE peuvent continuer :
- D’être mis sur le marché ou mis en service jusqu’au 31 décembre 2027 ;
- D’être utilisés jusqu’à la fin de leur durée de vie prévue par le fabricant.