Devant une couverture vaccinale insuffisante pour certaines vaccinations, la réapparition d’épidémies et à la suite des recommandations émises à l’issue de la concertation citoyenne organisée en 2016, le ministère de la Santé a recommandé, en juillet 2017, d’élargir l’obligation vaccinale à huit vaccins supplémentaires : coqueluche, Haemophilus influenzae b, hépatite B, méningocoque C, pneumocoque, rougeole, oreillons, rubéole.
Ces huit vaccins sont donc obligatoires depuis 2018 chez les enfants de moins de deux ans, en plus des trois vaccins déjà obligatoires (diphtérie, tétanos, poliomyélite). Il y a par conséquent 11 vaccins obligatoires en France.
Afin d’accompagner cette obligation vaccinale, nous mettons chaque année à disposition des professionnels de santé et du grand public les données de sécurité de cette obligation vaccinale.
Ces huit vaccins sont donc obligatoires depuis 2018 chez les enfants de moins de deux ans, en plus des trois vaccins déjà obligatoires (diphtérie, tétanos, poliomyélite). Il y a par conséquent 11 vaccins obligatoires en France.
Afin d’accompagner cette obligation vaccinale, nous mettons chaque année à disposition des professionnels de santé et du grand public les données de sécurité de cette obligation vaccinale.
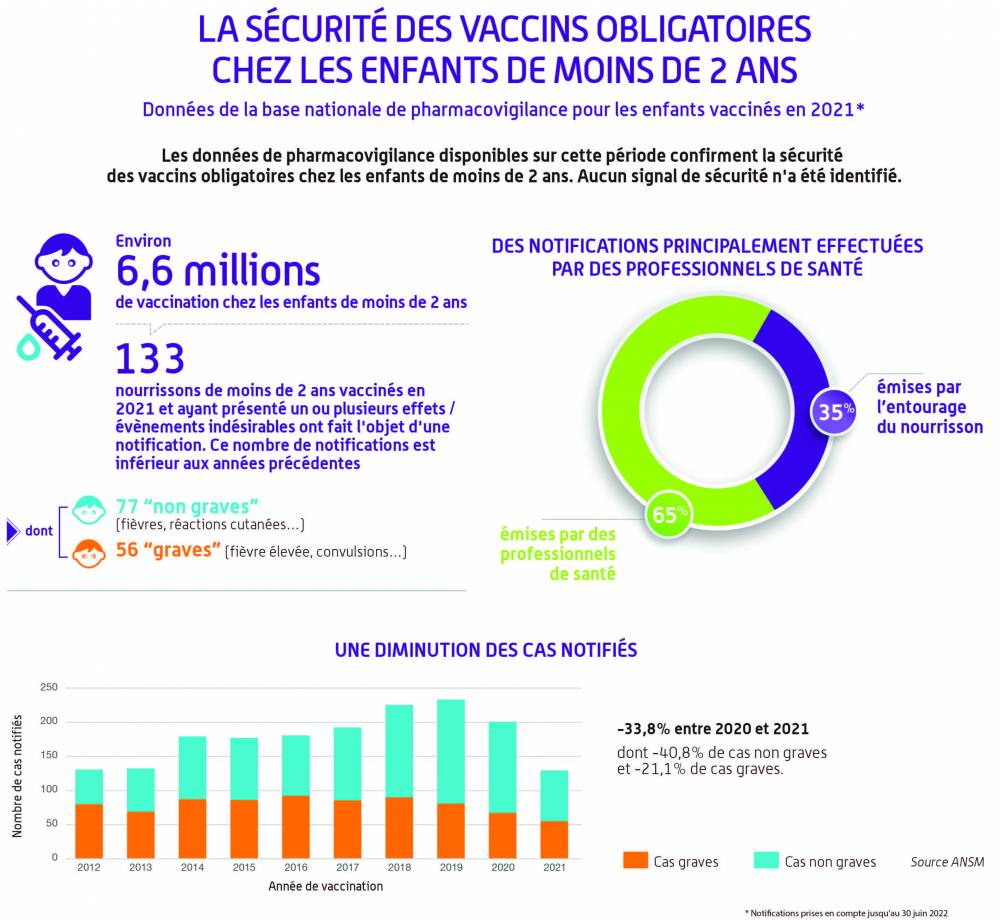
Chiffres clés de l’année 2021
D’où proviennent ces données ?
Ces données sont issues des déclarations réalisées par les professionnels de santé ou les parents au système national de pharmacovigilance (via le site signalement-sante.gouv.fr) ou directement auprès des centres régionaux de pharmacovigilances (CRPV)), ainsi que de celles réalisées directement par les professionnels de santé et les parents auprès des laboratoires pharmaceutiques.Le suivi des effets indésirables déclarés après une vaccination obligatoire est assuré par le CRPV de Bordeaux. Le CRPV de Lyon assure la relecture de l’analyse effectuée par le CRPV de Bordeaux.
Est-ce que toutes les déclarations figurent dans les rapports ?
Chaque rapport comprend l’ensemble des cas notifiés d’évènements / effets indésirables survenus chez un enfant vacciné entre 0 et 23 mois révolus dans l’année d’étude et concernant au moins un vaccin obligatoire codé “suspect” ou “interaction ” selon le critère d’imputabilité de l’Organisation mondiale de la santé (OMS).A noter : La période d’analyse est étendue de 6 mois par rapport à l’année étudiée afin d’intégrer les cas d’enfants vaccinés entre 0 et 23 mois révolus durant l’année d’étude mais dont la notification d’évènements / effets indésirables aurait eu lieu ultérieurement.
Cas déclaré, effet / évènement indésirable, évènement d’intérêt particulier, de quoi parle-t-on ?
Un “cas déclaré” correspond à un enfant vacciné chez lequel la survenue d’un ou de plusieurs évènements / effets indésirables après l’administration d’un vaccin a donné lieu à une notification de pharmacovigilance.Un évènement indésirable (EvI) correspond à toute manifestation nocive et non recherchée survenant chez un nourrisson vacciné, sans préjuger d’un lien de causalité. Un effet indésirable (EI) est défini comme une réaction nocive et non voulue suspectée d’être due à un vaccin, survenant dans les conditions d’utilisation conformes ou non conformes à celles prévues par l’autorisation de mise sur le marché (AMM) du vaccin.
Par conséquent, un effet indésirable est un évènement indésirable susceptible d’être lié à un vaccin.
Nous portons une attention particulière à un certain nombre d’évènements ou d’effets indésirables dits “d’intérêt particulier” (EEIP), tels que les convulsions, les thrombopénies, les échecs vaccinaux confirmés.
Des évènements indésirables dits “sensibles” font par ailleurs l’objet d’un suivi particulier en raison de préoccupations émanant des professionnels de santé ou des usagers sans qu’un lien de causalité ait été, à ce jour, démontré.
Consultez la liste des EEIP et des évènements indésirables dits sensibles
| Effets ou évènements indésirables attendus | Évènements indésirables dits “sensibles” |
|---|---|
| Réaction d’hypersensibilité immédiate | Décès |
| Thrombopénie | Troubles du neurodéveloppement |
| Apnée | Myofasciite à macrophages |
| Convulsions | Atteintes démyélinisantes centrales |
| Encéphalopathie aiguë | Atteintes démyélinisantes périphériques |
| Épisode d’hypotonie hyporéactivité | Maladie de Kawasaki |
| Echec vaccinal confirmé |
Comment sont classés les cas déclarés ?
Les cas déclarés sont classés selon leur gravité (grave ou non grave) et leur caractère inattendu (attendu si la description figure dans le résumé des caractéristiques du produit et la notice, ou inattendu si elle ne l’est pas).Est-ce que tous les évènements / effets indésirables déclarés et présentés dans les rapports sont liés à la vaccination ?
Les données présentées dans ces rapports concernent majoritairement des effets/évènements indésirables suspectés mais qui ne sont pas obligatoirement liés ou dus aux vaccins. C’est le CRPV qui définit en fonction de toutes les informations disponibles si l’effet/évènement indésirable est imputable aux vaccins.Est-ce que les déclarations seules permettent de déterminer les risques liés aux vaccins ?
Le système de notification spontanée de pharmacovigilance par les professionnels de santé et les usagers ne permet pas et n’a pas pour objectif d’estimer la fréquence d’apparition des effets/évènements indésirables. Ainsi, les taux de notification reflètent une activité de notification des cas présentant des effets indésirables et l’analyse au cas par cas permet de détecter des signaux. La notification étant spontanée, il est probable qu’une sous-notification des effets indésirables soit observée.Quels sont les vaccins concernés par l’obligation vaccinale et le calendrier vaccinal ?
- Vaccins contenant les valences diphtérie (D), tétanos (T), coqueluche acellulaire (Ca), poliomyélite (P), Haemophilus influenzae de type b (Hib), hépatite B (Hep B) : hexavalents (Infanrix Hexa, Hexyon, Vaxelis), pentavalents (Infanrix Quinta, Pentavac), tétravalents (Infanrix Tetra, Tetravac acellulaire), monovalents (Act-Hib, Engerix B10, HBVaxPro 5) ;
- Vaccin pneumococcique conjugué 13 valent (Pn) : Prevenar 13 ;
- Vaccin méningococcique conjugué contre le sérogroupe C (MenC) : Neisvac, Menjugate
- Vaccins contenant les valences rougeole-oreillons-rubéole (ROR) : Priorix, M-M-RVaxPro.
Que faire en cas de survenue d’un effet indésirable ?
En cas d’effet indésirable survenant chez votre enfant, n’hésitez pas à demander conseil à un professionnel de santé. Il pourra vous indiquer la conduite à tenir.Vous pouvez également le déclarer via le portail des signalements : signalement-sante.gouv.fr
- Données de sécurité des vaccins obligatoires pour les enfants vaccinés avant l’âge de 2 ans en 2019 (bilan au 30 juin 2020) - Rapport (03/08/2021)
- Données de sécurité des vaccins obligatoires pour les enfants vaccinés avant l’âge de 2 ans en 2018 (bilan au 30 juin 2019) – Rapport (30/06/2020)
- Données de sécurité des vaccins obligatoires pour les enfants vaccinés avant l’âge de 2 ans entre 2012 et 2017 (Bilan au 30 juin 2019)
- La sécurité des vaccins obligatoires chez les enfants de moins de 2 ans - Données de la base nationale de pharmacovigilance pour les enfants vaccinés en 2018 (30/06/2020)