Nouveau réglement européen
Le règlement européen (UE) 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro (appelé « RDIV ») abroge la directive 98/79/CE et la décision 2010/227/UE de la Commission. Il vise à renforcer et harmoniser dans l’Union européenne l’ensemble de la réglementation relative aux dispositifs médicaux de diagnostic in vitro (DIV).
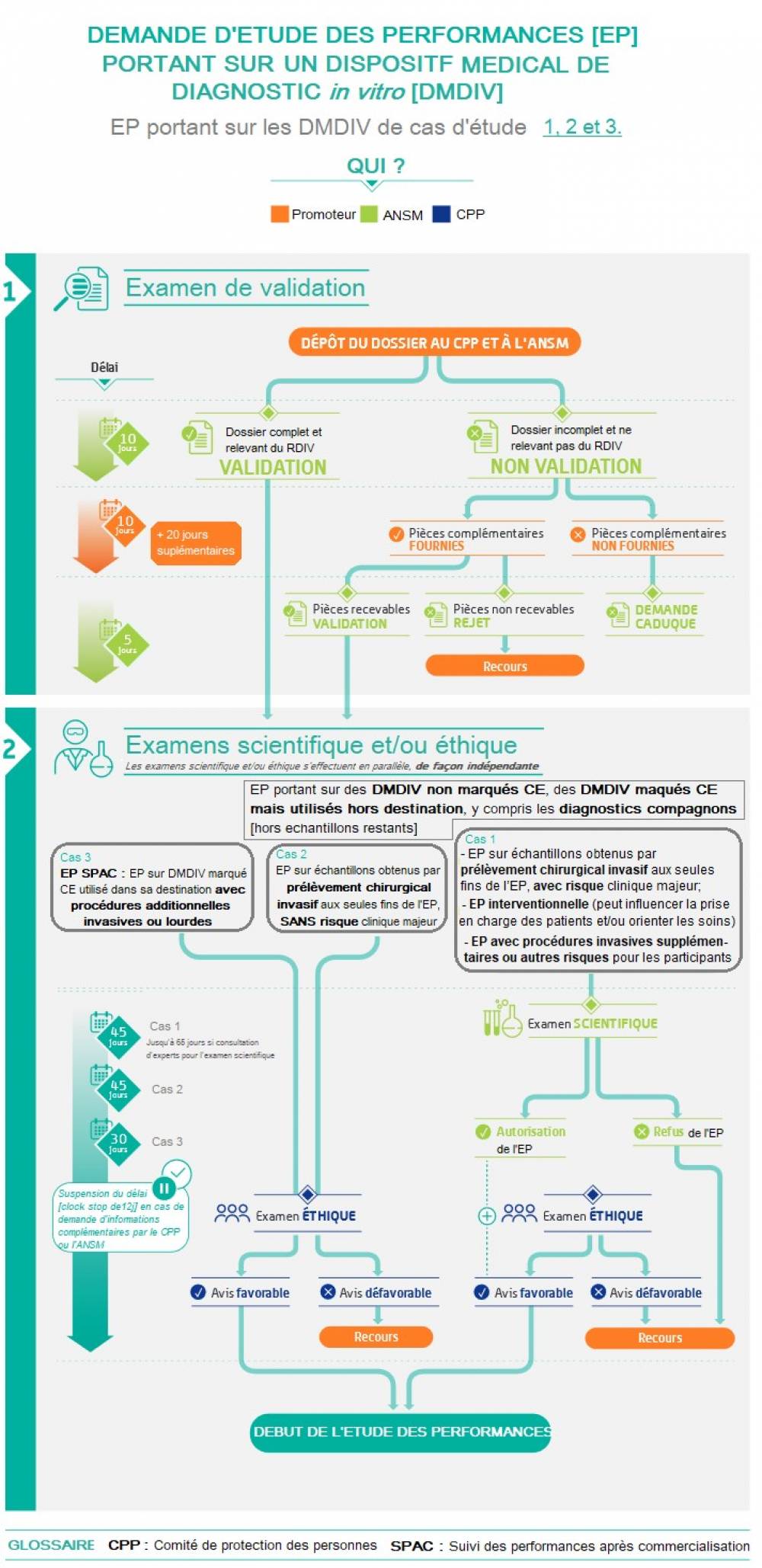
Le chapitre VI du RDIV est tout particulièrement dédié aux études des performances (EP) d’un DIV.
Les projets de recherche visant à évaluer un DIV et entrant dans le champ d’application du RDIV sont nommés « études des performances » (EP) et doivent se conformer aux dispositions du règlement à compter du 26 mai 2022.
Aussi, depuis le 26 mai 2022, la mise en œuvre des projets de recherches doit s’inscrire :
À ces différents cas d’EP correspondent des procédures d’évaluation spécifiques. De façon générale, les EP régies par le RDIV font l’objet d’un examen scientifique et éthique (article 58.3 du RDIV) et ne peuvent être mises en œuvre en France que lorsqu’un avis favorable a été émis par un comité d’éthique (CPP) et le cas échéant, pour certaines EP, après autorisation de l’ANSM.
Le règlement prévoit le fonctionnement d'une base de données sous-tendant un certain nombre de fonctions connue sous le nom de « Eudamed », dont certains modules, et notamment celui portant sur les EP, ne seront pas fonctionnels avant 2028.
Le chapitre VI du RDIV est tout particulièrement dédié aux études des performances (EP) d’un DIV.
Les projets de recherche visant à évaluer un DIV et entrant dans le champ d’application du RDIV sont nommés « études des performances » (EP) et doivent se conformer aux dispositions du règlement à compter du 26 mai 2022.
Aussi, depuis le 26 mai 2022, la mise en œuvre des projets de recherches doit s’inscrire :
- Soit dans le cadre du RDIV, pour les études des performances entrant dans le champ d’application du Règlement (UE) 2017/746 ;
- Soit dans le cadre de la législation nationale relative aux collections d’échantillons biologiques, ou aux recherches impliquant la personne humaine (RIPH) (loi dite « Jardé »), pour les projets de recherche ne rentrant pas dans le champ d’application du RDIV.
À ces différents cas d’EP correspondent des procédures d’évaluation spécifiques. De façon générale, les EP régies par le RDIV font l’objet d’un examen scientifique et éthique (article 58.3 du RDIV) et ne peuvent être mises en œuvre en France que lorsqu’un avis favorable a été émis par un comité d’éthique (CPP) et le cas échéant, pour certaines EP, après autorisation de l’ANSM.
Le règlement prévoit le fonctionnement d'une base de données sous-tendant un certain nombre de fonctions connue sous le nom de « Eudamed », dont certains modules, et notamment celui portant sur les EP, ne seront pas fonctionnels avant 2028.
À retenir
Recommandation concernant les modifications substantielles
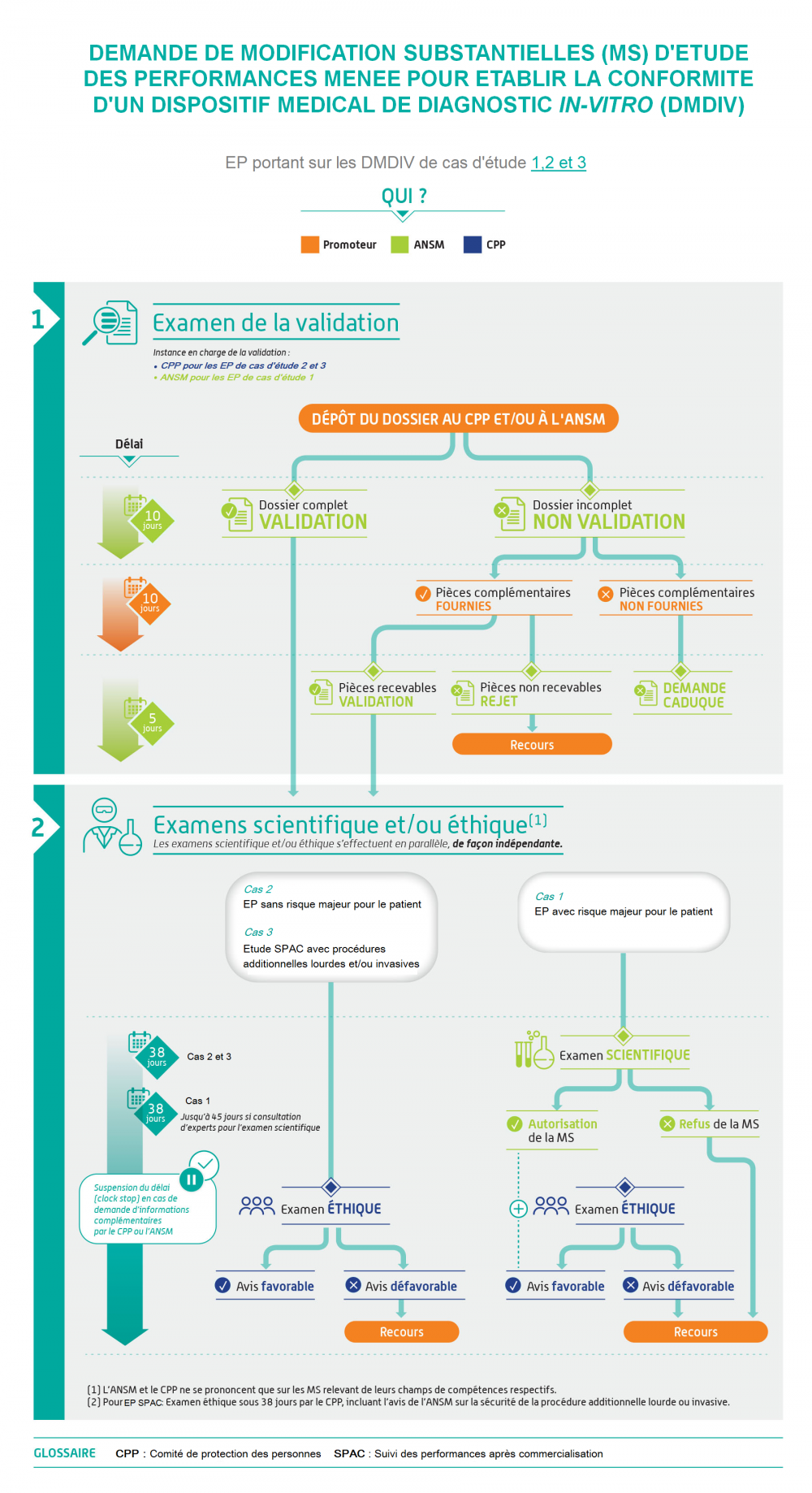
Aucune demande de MS (Modification substantielle) ne peut être déposée par le promoteur tant que les procédures d'évaluation d'Investigation clinique ne sont pas finalisées auprès de chacune des entités ANSM (avec une décision d'autorisation) et CPP (avec une décision d'avis favorable).Recommandations concernant les recherches mixtes
Ce document, établi en concertation avec les représentants des comités de protection des personnes, l’Agence national de sécurité du médicament et le ministère de la santé reprend les différentes recommandations relatives au dépôt et à l’évaluation des dossiers de demande de recherche associant un médicament à un dispositif médical ou un dispositif médical de diagnostic in vitro.Recommandations nationales concernant la phase pilote Combine
Ce document, établi en concertation avec les représentants des comités de protection des personnes, l’Agence national de sécurité du médicament et le ministère de la santé reprend les différentes recommandations relatives au dépôt et à l’évaluation des dossiers déposés dans le cadre de la phase I de la procédure européenne Combine.Étude des performances de DMDIV selon le règlement (UE) 2017/746
Dispositions générales
Avis aux promoteurs (EP déposées à partir du 26 mai 2022) – Partie I
Comment soumettre et comment est traitée ma demande ?
Avis aux promoteurs (EP déposées à partir du 26 mai 2022) – Partie II
Recherche impliquant la personne humaine portant sur un DMDIV
Avis aux promoteurs pour les RIPH1 déposées avant le 26 mai 2022 et les RIPH correspondant au cas 5 décrit dans le cadre des recherches DMDIV dont les études de performances selon le règlement (UE) 2017/746.
Formulaires
Demande de modification substantielle et autres modifications
| Aucune demande de MS (Modification Substantielle) ne peut être déposée par le promoteur tant que les procédures d'évaluation d'étude des performances ne sont pas finalisées auprès de chacune des entités ANSM (avec une décision d'autorisation) et CPP ( avec une décision d'avis favorable). |
![Cas de recherches dont les études des performances de DMDIV selon le règlement [UE] 2017/746 [RDIV] - Voie réglementaire](https://ansm.sante.fr/media/cache/block_slider/uploads/2022/07/08/20220706-ansm-infographie-dmdiv-voie-reglementaire-5.jpg)