PUBLIÉ LE 30/11/2022
- MIS À JOUR LE 20/02/2026
Finastéride 1 mg (Propecia et génériques) : ajout de mentions d’alerte sur les boîtes pour renforcer l’information sur les effets indésirables
Actualisation du 20/02/2026Pour renforcer l’information des patients, une attestation d'information partagée, cosignée par le médecin et le patient, sera obligatoire à partir du 16/04/2026. Elle remplace le document d'information qui sera caduc. |
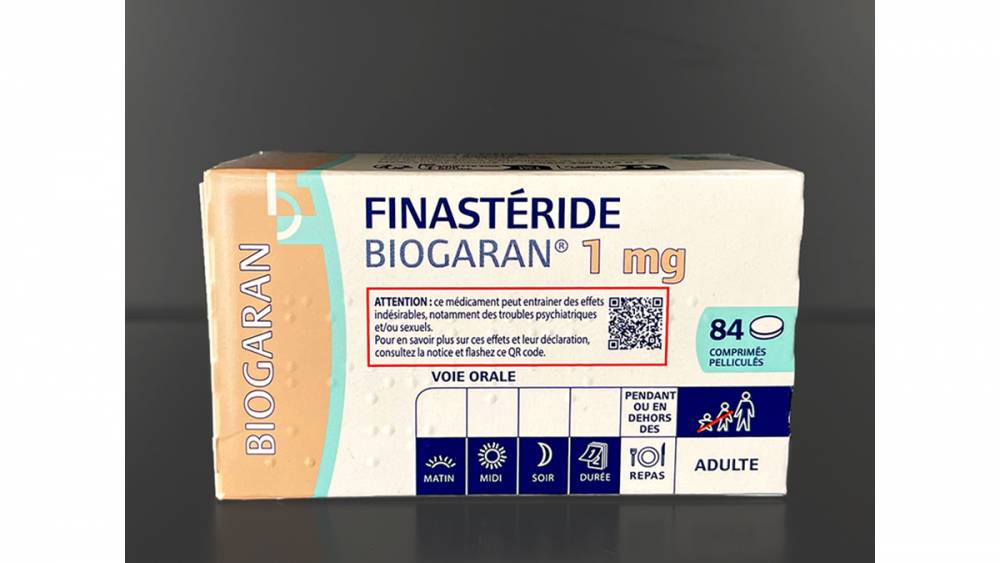
Actualisation du 24/05/2023Depuis le 28 avril 2023, sont progressivement mises sur le marché des boîtes de finastéride 1 mg comportant sur leur face principale (face avant) un encadré rouge indiquant que des effets indésirables de type sexuel et/ou psychiatrique peuvent survenir pendant et après le traitement, accompagné d’un QR code qui renvoie à notre dossier thématique « Finastéride 1 mg et chute de cheveux ». |
| Par ailleurs, le laboratoire Organon a informé l’ANSM de l’arrêt de commercialisation de Propecia 1 mg (84 comprimés), effectif depuis le 31 janvier 2023, ainsi que celui de Propecia 1 mg (28 comprimés) depuis le 27 avril 2023. Si nécessaire, le pharmacien dispensera l’un de ses génériques. Consultez la liste des médicaments contenant du finastéride commercialisés en France |
Dans le prolongement de nos actions visant à renforcer l’information des patients sur les effets indésirables potentiels, notamment psychiatriques et sexuels, des médicaments contenant du finastéride 1 mg, et sur la déclaration de ces effets, nous avons demandé aux industriels concernés qu’un message d’alerte accompagné d’un QR code soit désormais apposé sur les boîtes de ces médicaments.
Ainsi, le 28 avril 2023 au plus tard, les boîtes des médicaments à base de finastéride 1 mg comporteront sur leur face principale (face avant) :
-
Un encadré rouge indiquant que des effets indésirables de type sexuel et/ou psychiatrique peuvent survenir pendant et après le traitement ;
-
Un QR code renvoyant vers notre dossier thématique « Finastéride 1 mg et chute de cheveux ».
 En parallèle, la fiche d’information destinée aux patients afin de les sensibiliser sur ces risques d’effets psychiatriques et/ou sexuels a été actualisée.
En parallèle, la fiche d’information destinée aux patients afin de les sensibiliser sur ces risques d’effets psychiatriques et/ou sexuels a été actualisée.
Nous rappelons que le finastéride 1 mg est indiqué dans les formes peu évoluées d’alopécie (calvitie) d’origine androgénétique chez l’homme âgé de 18 à 41 ans.
Information pour les patients
Le finastéride peut être à l’origine d’effets indésirables, en particulier psychiatriques et sexuels, dont l’impact peut être important. Il est essentiel de les connaître avant de débuter un traitement et d’être suivi tout au long de ce traitement.
Si vous présentez un effet indésirable suite à la prise de finastéride, vous pouvez le déclarer vous-même si un professionnel de santé ne l’a pas déjà fait. Pour vous aider dans cette déclaration, vous pouvez consulter la vidéo consacrée spécifiquement au signalement des effets indésirables de ce médicament.
Si vous présentez un effet indésirable suite à la prise de finastéride, vous pouvez le déclarer vous-même si un professionnel de santé ne l’a pas déjà fait. Pour vous aider dans cette déclaration, vous pouvez consulter la vidéo consacrée spécifiquement au signalement des effets indésirables de ce médicament.