PUBLIÉ LE 01/02/2021
- MIS À JOUR LE 04/05/2022
L’ANSM évolue pour répondre toujours mieux à ses missions de service public pour la sécurité des patients
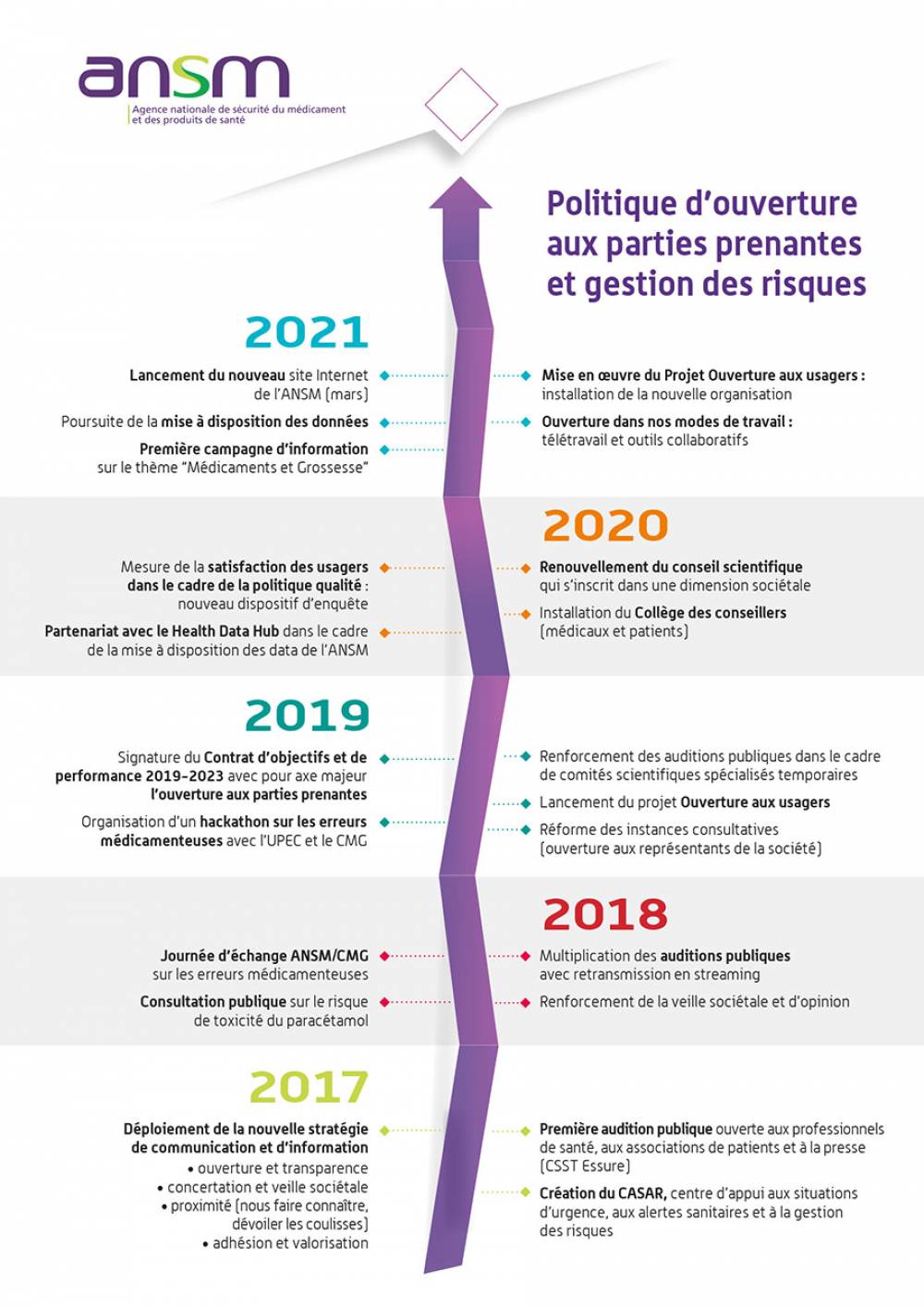
L’Agence nationale de sécurité des médicaments et des produits de santé (ANSM) a pris l’engagement d’agir au quotidien dans l’intérêt des patients pour assurer la sécurité d’emploi des produits de santé.
Cette volonté est inscrite dans son contrat d’objectifs et de performance (COP) 2019-2023 signé avec l’Etat. Elle se manifeste par sa politique d’ouverture aux usagers, patients et professionnels de santé, sa stratégie de gestion de risques comme principe commun à toutes ses décisions et le renforcement de son positionnement européen.
Afin de répondre à ces enjeux et promouvoir excellence scientifique et vision de service public, l’ANSM a lancé depuis 2019 un processus d’évolution qui se concrétise aujourd’hui avec la mise en place de nouveaux services pour ses publics à partir du 1er février 2021.
Les organisations et missions ancrées sur la surveillance des produits de santé l’inspection, le contrôle de la qualité des produits en laboratoire et l’évaluation des dispositifs médicaux demeurent inchangées.
Ces nouveaux services, cette nouvelle organisation fondée sur la collégialité, la transversalité et la simplification des échanges avec nos publics vise à toujours mieux répondre au quotidien à nos missions de santé publique et de sécurité sanitaire avec efficacité, engagement, transparence et agilité.
Cette volonté est inscrite dans son contrat d’objectifs et de performance (COP) 2019-2023 signé avec l’Etat. Elle se manifeste par sa politique d’ouverture aux usagers, patients et professionnels de santé, sa stratégie de gestion de risques comme principe commun à toutes ses décisions et le renforcement de son positionnement européen.
Afin de répondre à ces enjeux et promouvoir excellence scientifique et vision de service public, l’ANSM a lancé depuis 2019 un processus d’évolution qui se concrétise aujourd’hui avec la mise en place de nouveaux services pour ses publics à partir du 1er février 2021.
- Un dialogue renforcé avec les patients, les professionnels de santé et leurs représentants avec la création, de deux Directions médicales dédiées aux médicaments
- Un point d’entrée unique pour les industries de santé avec un pilotage centralisé et coordonné des dossiers d’autorisation de mise sur le marché, d’essais cliniques, d’accès précoce… avec la création d’une Direction des autorisations
- Une approche scientifique d’excellence avec la création d’une Direction des métiers scientifiques
- Une vision intégrée Europe et Accès à l’innovation avec la création d’une Direction Europe et Innovation
- Prochainement, un nouveau site Internet d’information et des démarches simplifiées dans la relation des usagers avec l’ANSM
- Un numéro unique pour joindre l’ANSM
Les organisations et missions ancrées sur la surveillance des produits de santé l’inspection, le contrôle de la qualité des produits en laboratoire et l’évaluation des dispositifs médicaux demeurent inchangées.
Ces nouveaux services, cette nouvelle organisation fondée sur la collégialité, la transversalité et la simplification des échanges avec nos publics vise à toujours mieux répondre au quotidien à nos missions de santé publique et de sécurité sanitaire avec efficacité, engagement, transparence et agilité.