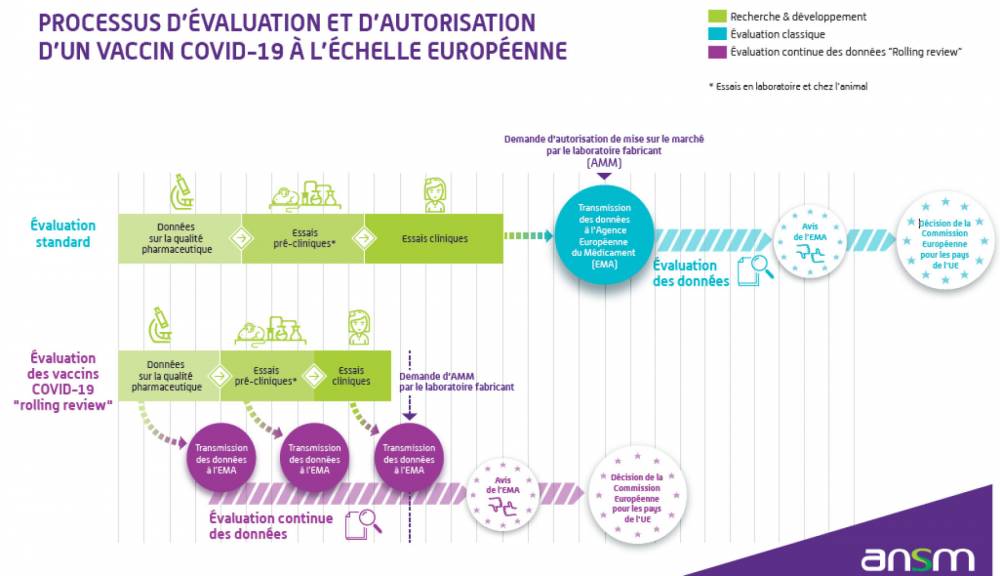
Comme tout médicament, les vaccins contre le Covid-19 ne peuvent être mis sur le marché que s’ils ont obtenu une autorisation de mise sur le marché (AMM) après une évaluation rigoureuse par une autorité indépendante.
En Europe, c’est l’Agence européenne des médicaments (EMA) qui organise l’évaluation des vaccins contre le Covid-19, en s’appuyant sur l’expertise des 27 agences nationales. En France, il s’agit de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Dans le contexte de pandémie, l’EMA a décidé que cette évaluation approfondie serait réalisée en continu (autrement appelé “rolling review”), au fur et à mesure que les résultats des études sont disponibles. L’évaluation des premiers vaccins contre le Covid-19 a ainsi été réalisée sur une période plus courte qu’à l’accoutumée.
Les autorisations de mise sur le marché (AMM) sont délivrées par la Commission européenne à l’issue de cette évaluation et sont valables dans tous les États membres de l’Union européenne. Dans le contexte de la pandémie et de l’urgence de santé publique, les AMM ont dans un premier temps été conditionnelles. Sur la base des informations issues de notre surveillance et des données internationales, l’Agence européenne du médicament (EMA) a pérennisé entre fin 2021 et 2022 les autorisations de mise sur le marché conditionnelle (AMMc) des vaccins Comirnaty (Pfizer/BioNTech), Jcovden (Janssen), Nuvaxovid (Novavax), Spikevax (Moderna) et Vaxzevria (AstraZeneca) en AMM “standard”. L’AMM de Vaxzevria a été abrogée en mars 2024 à la demande du laboratoire AstraZeneca qui ne souhaitait plus le commercialiser, celle de Jcovden a été abrogée à l’été 2024.
Ainsi, la surveillance renforcée des vaccins contre le Covid-19 a été majeure pour conforter leur efficacité dans la population ainsi que pour identifier les éventuels effets indésirables qui n’auraient pas été observés lors des essais cliniques.
En effet, la totalité des effets indésirables liés à un médicament n’est pas toujours connue lors de sa mise sur le marché. Les principales informations ont été réunies au moment des essais cliniques mais ceux-ci sont réalisés sur une petite partie de la population et dans des conditions bien définies.
C’est pourquoi, lorsque le médicament arrive sur le marché et devient disponible pour un plus grand nombre de personnes, il continue à être suivi et analysé pour mettre à jour les connaissances, en tenant compte de son utilisation dans la vie quotidienne.
En Europe, c’est l’Agence européenne des médicaments (EMA) qui organise l’évaluation des vaccins contre le Covid-19, en s’appuyant sur l’expertise des 27 agences nationales. En France, il s’agit de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Dans le contexte de pandémie, l’EMA a décidé que cette évaluation approfondie serait réalisée en continu (autrement appelé “rolling review”), au fur et à mesure que les résultats des études sont disponibles. L’évaluation des premiers vaccins contre le Covid-19 a ainsi été réalisée sur une période plus courte qu’à l’accoutumée.
Les autorisations de mise sur le marché (AMM) sont délivrées par la Commission européenne à l’issue de cette évaluation et sont valables dans tous les États membres de l’Union européenne. Dans le contexte de la pandémie et de l’urgence de santé publique, les AMM ont dans un premier temps été conditionnelles. Sur la base des informations issues de notre surveillance et des données internationales, l’Agence européenne du médicament (EMA) a pérennisé entre fin 2021 et 2022 les autorisations de mise sur le marché conditionnelle (AMMc) des vaccins Comirnaty (Pfizer/BioNTech), Jcovden (Janssen), Nuvaxovid (Novavax), Spikevax (Moderna) et Vaxzevria (AstraZeneca) en AMM “standard”. L’AMM de Vaxzevria a été abrogée en mars 2024 à la demande du laboratoire AstraZeneca qui ne souhaitait plus le commercialiser, celle de Jcovden a été abrogée à l’été 2024.
Ainsi, la surveillance renforcée des vaccins contre le Covid-19 a été majeure pour conforter leur efficacité dans la population ainsi que pour identifier les éventuels effets indésirables qui n’auraient pas été observés lors des essais cliniques.
En effet, la totalité des effets indésirables liés à un médicament n’est pas toujours connue lors de sa mise sur le marché. Les principales informations ont été réunies au moment des essais cliniques mais ceux-ci sont réalisés sur une petite partie de la population et dans des conditions bien définies.
C’est pourquoi, lorsque le médicament arrive sur le marché et devient disponible pour un plus grand nombre de personnes, il continue à être suivi et analysé pour mettre à jour les connaissances, en tenant compte de son utilisation dans la vie quotidienne.
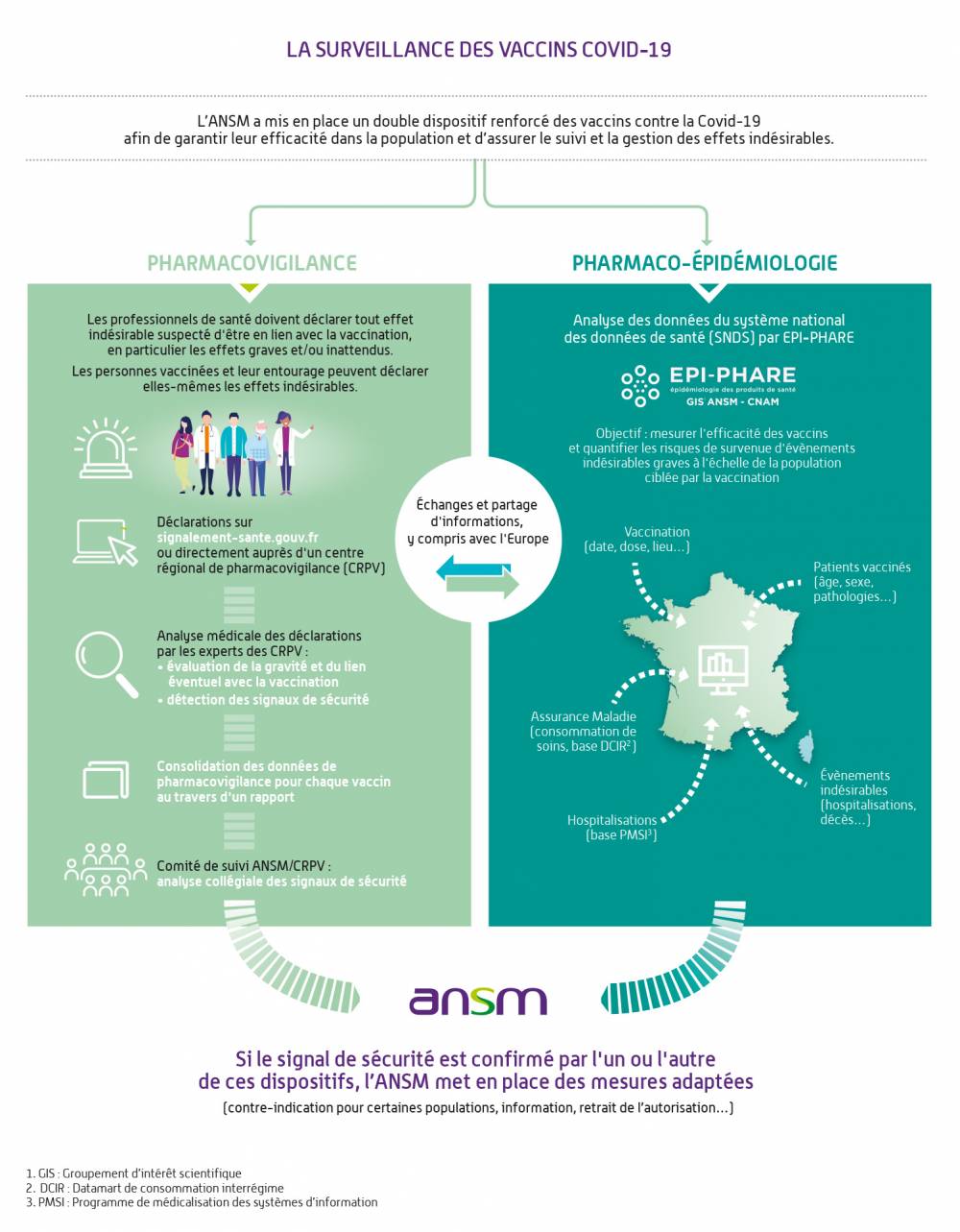
Un dispositif de surveillance renforcée
Depuis fin décembre 2020, l’ANSM a déployé un dispositif de surveillance renforcée, en lien avec le réseau français des centres régionaux de pharmacovigilance (CRPV) et le groupement d’intérêt scientifique Epi-Phare (ANSM / Assurance Maladie), qui a reposé sur :
Le dispositif de surveillance renforcée a été adapté au fur et à mesure de l’évolution des connaissances sur les vaccins et de la campagne de vaccination. Il a été adapté tant en termes de méthodologie suivie que de type de population particulière à surveiller.
- L’analyse en temps réel des effets indésirables déclarés par des professionnels de santé et des patients au système national et européen de pharmacovigilance avec évaluation collégiale des signaux de sécurité dans le cadre d’un comité de suivi mis en place par l’ANSM, en lien avec les CRPV ;
- La conduite d’études de pharmaco-épidémiologie.
Le dispositif de surveillance renforcée a été adapté au fur et à mesure de l’évolution des connaissances sur les vaccins et de la campagne de vaccination. Il a été adapté tant en termes de méthodologie suivie que de type de population particulière à surveiller.