Nos échanges avec notre environnement
Le dialogue et le partage de l’information avec les professionnels de santé, les patients et plus largement le grand public, sont au cœur des missions de l’ANSM. Nous travaillons en lien étroit avec l’ensemble de nos parties prenantes, en concertation avec les patients et les professionnels afin que notre action réponde aux enjeux auxquels ils font face.
L’élaboration d’une politique volontariste de publications des données de l’Agence s’inscrit dans cette politique d’ouverture qui vise à mieux faire connaître de tous les actions de l’Agence, valoriser son expertise et favoriser l’exploitation de ses données.
L’ANSM coopère par ailleurs à l’échelle européenne et internationale en participant aux travaux des autorités sanitaires du réseau de l’Union européenne et en siégeant à la Coalition internationale des autorités de réglementation des médicaments.
Dans cette approche collégiale, transversale, transparente et déontologique, les décisions de l’Agence s'appuient sur les avis de plusieurs comités consultatifs, parmi lesquels le Comité d’information sur les produits de santé (CIPS) dédié aux questions d’information et de communication. Focus.
L’élaboration d’une politique volontariste de publications des données de l’Agence s’inscrit dans cette politique d’ouverture qui vise à mieux faire connaître de tous les actions de l’Agence, valoriser son expertise et favoriser l’exploitation de ses données.
L’ANSM coopère par ailleurs à l’échelle européenne et internationale en participant aux travaux des autorités sanitaires du réseau de l’Union européenne et en siégeant à la Coalition internationale des autorités de réglementation des médicaments.
Dans cette approche collégiale, transversale, transparente et déontologique, les décisions de l’Agence s'appuient sur les avis de plusieurs comités consultatifs, parmi lesquels le Comité d’information sur les produits de santé (CIPS) dédié aux questions d’information et de communication. Focus.
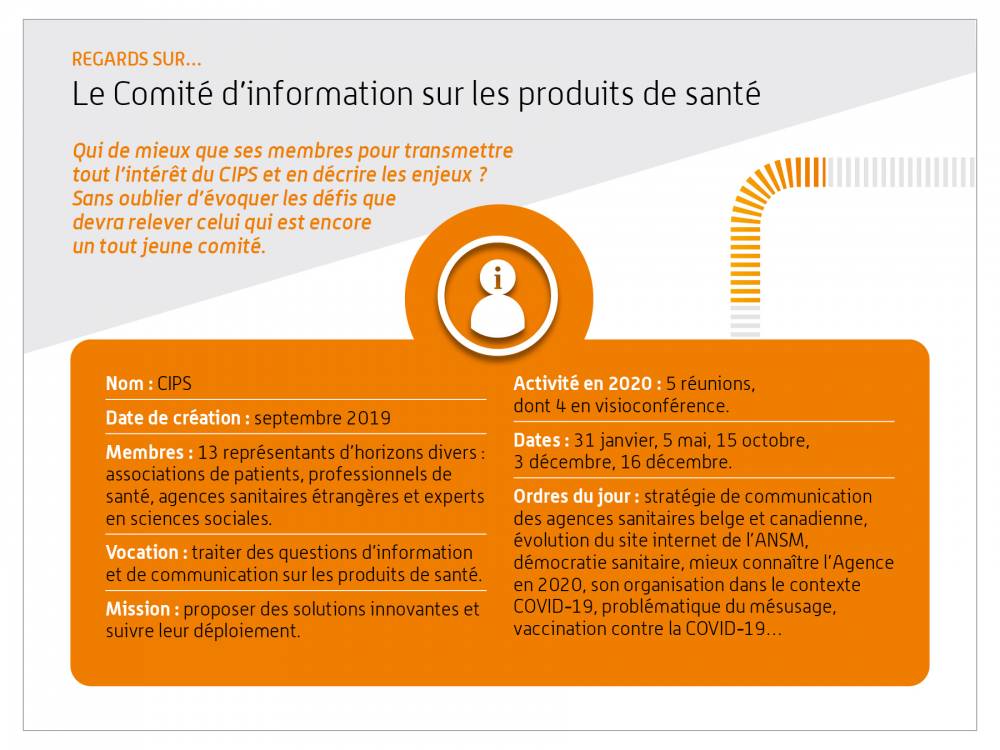
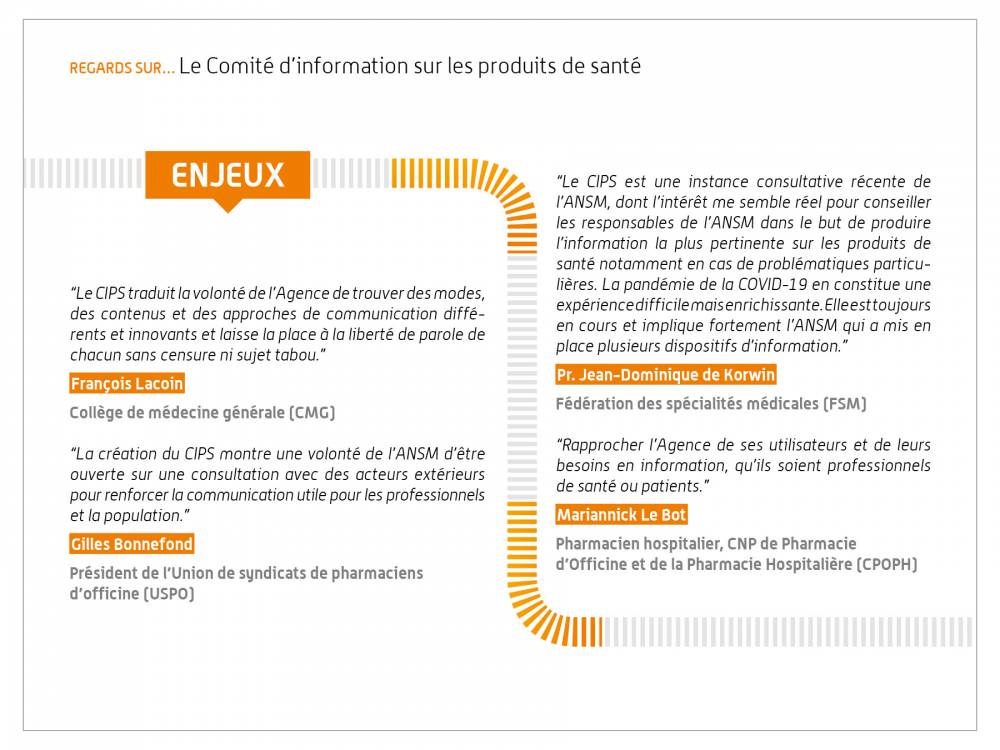
Regards sur… le Comité d’information sur les produits de santé
Qui de mieux que ses membres pour transmettre tout l’intérêt du CIPS et en décrire les enjeux ?
Sans oublier d’évoquer les défis que devra relever celui qui est encore un tout jeune comité.
Temps forts
Installation du Collège des conseillers
Dans le cadre de sa stratégie d'ouverture aux publics et aux usagers, l’ANSM a constitué un collège d’appui et d’interface composé de directeurs, des conseillers médicaux des directions et de la conseillère patiente.
Le Collège des conseillers médicaux et patients est une instance interne travaillant en étroite relation avec le Comité des directions opérationnelles (CODOP) pour apporter appui et conseil aux directions et aux évaluateurs. Il s’est réuni pour la première fois au mois de février 2020.
Ses trois objectifs sont :
Le Collège des conseillers médicaux et patients est une instance interne travaillant en étroite relation avec le Comité des directions opérationnelles (CODOP) pour apporter appui et conseil aux directions et aux évaluateurs. Il s’est réuni pour la première fois au mois de février 2020.
Ses trois objectifs sont :
- de définir des politiques de santé publique collectives et consensuelles sur les produits de santé,
- d’être une interface en prise directe avec les préoccupations des patients et des professionnels de santé,
- de soutenir l'expertise collégiale avec un point de vue médical, scientifique et patient.
Consultation publique Lutényl, Lutéran et le risque de méningiome
L’acétate de nomégestrol (Lutényl) et l’acétate de chlormadinone (Lutéran) sont des traitements hormonaux dérivés de la progestérone. Ils sont utilisés dans la prise en charge de certains désordres gynécologiques.
En 2019, près de 400 000 femmes avaient consommé ces médicaments en France.
Pourquoi Lutényl et Lutéran ont-ils fait l’objet d’une attention particulière ?
Isabelle Yoldjian : Ces médicaments progestatifs sont des cousins de l’acétate de cyprotérone (Androcur). Or, nous savons depuis 2018 que son utilisation prolongée est liée à un risque important de développer une tumeur cérébrale, le méningiome.
La proximité entre ces trois médicaments associée aux cas de méningiomes rapportés en pharmacovigilance avec l’acétate de nomégestrol (Lutényl) et l’acétate de chlormadinone (Lutéran) nous faisaient redouter ce risque. Nous avons donc demandé au GIS Epi-Phare de mener une étude épidémiologique pour déterminer si le risque de méningiome était aussi majoré par la prise de Lutényl et Lutéran. Les résultats ont confirmé nos soupçons.
Une fois le sur-risque établi, quel a été le rôle du comité scientifique temporaire (CST) ?
I.Y : Le CST a d’abord discuté des résultats de l’étude et a confirmé l’utilité de ces médicaments dans certaines situations. Il n’était pas question de les interdire mais bien de réduire ce risque de méningiome.
Les membres avaient déjà travaillé sur Androcur et le comité avait très bien fonctionné, il était évident de s’appuyer à nouveau sur son expertise. Pour Androcur, le comité comportait uniquement des scientifiques et des médecins et nous avions monté un groupe de travail impliquant plusieurs acteurs associatifs et des patients, mais aussi des professionnels de santé et l’Assurance Maladie, afin de décliner les mesures sous forme d’information pour les patients et les praticiens.
Axelle de Franssu : Pour Lutényl et Lutéran, dès que nous avons eu connaissance du risque, nous avons choisi d’intégrer au sein du comité des associations de patientes et de victimes, avec le même poids dans la prise de parole que les professionnels de santé. La réflexion sur l’encadrement du risque a ainsi pu être immédiatement plurielle. Mais nous souhaitions aller plus loin et recueillir l’expérience de femmes traitées et entendre leurs attentes en matière d’information.
Vous avez organisé une audition publique précédée d’un appel à témoignages. Quels enseignements tirez-vous de cette expérience ?
Malika Boussaid : Le principal objectif d'une audition publique est de permettre aux parties prenantes et en particulier aux patients de venir s’exprimer sur une problématique qui les concerne pour recueillir leur point de vue. L’appel à témoignages a été largement relayé, notamment par les associations et via les médias sur les réseaux sociaux. Nous avons reçu énormément d’appels téléphoniques de patientes, ainsi que 600 témoignages : 350 contributions écrites et 250 propositions de prise de parole.
A. d.F : La sélection des patientes venant témoigner s’est opérée avec la volonté de permettre à toutes les situations d’être représentées. L’ensemble des témoignages écrits a été transmis aux membres du comité pour qu’ils en prennent connaissance.
I.Y. : Ce comité a représenté un travail collectif et transversal entre nos directions. Nous avions tous le même but : réussir cette audition et faire entendre la voix des femmes.
M. B. : En raison du deuxième confinement, tout s’est fait en distanciel. La session a été découpée en deux temps, un temps d’audition et, plus tard, un temps d’échanges entre les membres du CST. Les auditions ont été retransmises sur la chaîne Youtube de l’Agence.
Aujourd’hui, où en sont les travaux du CST ?
A. d.F. : Le relais a été important, ce q ui a permis à de nombreuses femmes de prendre conscience des risques encourus. Les professionnels de santé ont été destinataires de messages précisant les nouvelles conditions de prescription et de suivi des patientes.
I.Y : L’ouverture du CST aux associations et à la parole directe des patientes fait bouger les choses. Je n’imagine pas revenir en arrière. Les médecins sont certes moins directs dans leur expression que lorsqu’ils n’échangent qu’entre professionnels de santé mais ils se projettent dans leur pratique, sur le terrain, et les témoignages ont tous été très constructifs. La prise de conscience est globale.
Et puis, une fois les rapports du GIS publiés, un volet européen s’ouvrira avec le partage à l’EMA : si les mesures prises en faveur des patientes françaises peuvent avoir un retentissement européen sur d’autres patientes exposées ailleurs, cela constituera une grande satisfaction.

Isabelle Yoldjian |

Malika Boussaid |

Axelle de Franssu |
En 2019, près de 400 000 femmes avaient consommé ces médicaments en France.
Pourquoi Lutényl et Lutéran ont-ils fait l’objet d’une attention particulière ?
Isabelle Yoldjian : Ces médicaments progestatifs sont des cousins de l’acétate de cyprotérone (Androcur). Or, nous savons depuis 2018 que son utilisation prolongée est liée à un risque important de développer une tumeur cérébrale, le méningiome.
La proximité entre ces trois médicaments associée aux cas de méningiomes rapportés en pharmacovigilance avec l’acétate de nomégestrol (Lutényl) et l’acétate de chlormadinone (Lutéran) nous faisaient redouter ce risque. Nous avons donc demandé au GIS Epi-Phare de mener une étude épidémiologique pour déterminer si le risque de méningiome était aussi majoré par la prise de Lutényl et Lutéran. Les résultats ont confirmé nos soupçons.
Une fois le sur-risque établi, quel a été le rôle du comité scientifique temporaire (CST) ?
I.Y : Le CST a d’abord discuté des résultats de l’étude et a confirmé l’utilité de ces médicaments dans certaines situations. Il n’était pas question de les interdire mais bien de réduire ce risque de méningiome.
Les membres avaient déjà travaillé sur Androcur et le comité avait très bien fonctionné, il était évident de s’appuyer à nouveau sur son expertise. Pour Androcur, le comité comportait uniquement des scientifiques et des médecins et nous avions monté un groupe de travail impliquant plusieurs acteurs associatifs et des patients, mais aussi des professionnels de santé et l’Assurance Maladie, afin de décliner les mesures sous forme d’information pour les patients et les praticiens.
Axelle de Franssu : Pour Lutényl et Lutéran, dès que nous avons eu connaissance du risque, nous avons choisi d’intégrer au sein du comité des associations de patientes et de victimes, avec le même poids dans la prise de parole que les professionnels de santé. La réflexion sur l’encadrement du risque a ainsi pu être immédiatement plurielle. Mais nous souhaitions aller plus loin et recueillir l’expérience de femmes traitées et entendre leurs attentes en matière d’information.
Vous avez organisé une audition publique précédée d’un appel à témoignages. Quels enseignements tirez-vous de cette expérience ?
Malika Boussaid : Le principal objectif d'une audition publique est de permettre aux parties prenantes et en particulier aux patients de venir s’exprimer sur une problématique qui les concerne pour recueillir leur point de vue. L’appel à témoignages a été largement relayé, notamment par les associations et via les médias sur les réseaux sociaux. Nous avons reçu énormément d’appels téléphoniques de patientes, ainsi que 600 témoignages : 350 contributions écrites et 250 propositions de prise de parole.
A. d.F : La sélection des patientes venant témoigner s’est opérée avec la volonté de permettre à toutes les situations d’être représentées. L’ensemble des témoignages écrits a été transmis aux membres du comité pour qu’ils en prennent connaissance.
I.Y. : Ce comité a représenté un travail collectif et transversal entre nos directions. Nous avions tous le même but : réussir cette audition et faire entendre la voix des femmes.
M. B. : En raison du deuxième confinement, tout s’est fait en distanciel. La session a été découpée en deux temps, un temps d’audition et, plus tard, un temps d’échanges entre les membres du CST. Les auditions ont été retransmises sur la chaîne Youtube de l’Agence.
Aujourd’hui, où en sont les travaux du CST ?
A. d.F. : Le relais a été important, ce q ui a permis à de nombreuses femmes de prendre conscience des risques encourus. Les professionnels de santé ont été destinataires de messages précisant les nouvelles conditions de prescription et de suivi des patientes.
I.Y : L’ouverture du CST aux associations et à la parole directe des patientes fait bouger les choses. Je n’imagine pas revenir en arrière. Les médecins sont certes moins directs dans leur expression que lorsqu’ils n’échangent qu’entre professionnels de santé mais ils se projettent dans leur pratique, sur le terrain, et les témoignages ont tous été très constructifs. La prise de conscience est globale.
Et puis, une fois les rapports du GIS publiés, un volet européen s’ouvrira avec le partage à l’EMA : si les mesures prises en faveur des patientes françaises peuvent avoir un retentissement européen sur d’autres patientes exposées ailleurs, cela constituera une grande satisfaction.
Nouvelle direction générale
Christelle Ratignier-Carbonneil a été nommée Directrice Générale de l’ANSM par décret du 14 décembre 2020. De nombreuses actions presse ont été réalisées dans ce cadre. Lors de ses interviews, elle a souligné sa vision stratégique en tant que nouvelle Directrice générale de l’ANSM et les dispositifs mis en place dans le cadre de l’arrivée des vaccins contre la COVID-19. Le Parisien, Le Monde et bien d’autres supports, lui ont ainsi accordé une pleine page d’interview constituant une belle visibilité pour un début de mandat.
Chiffres clés
- 83 réunions des Comités scientifiques permanents
- 175 déclarations publiques d'intérêt contrôlées
- 394 contributions et analyses
- 101 points d’information et 13 communiqués de presse publiés
- 4,3 millions de visiteurs uniques sur le site de l’ANSM
- 67 209 abonnés LinkedIn et 31 822 abonnés Twitter