Nouveau règlement européen
Depuis le 26 mai 2021, tous les projets de recherche visant à évaluer un dispositif médical, ou un dispositif utilisé à des fins non médicales listé à l’annexe XVI du règlement (UE) 2017/745, sont encadrés par le règlement (UE) 2017/745 relatifs aux dispositifs médicaux (appelé RDM) et sont nommés investigations cliniques (IC).
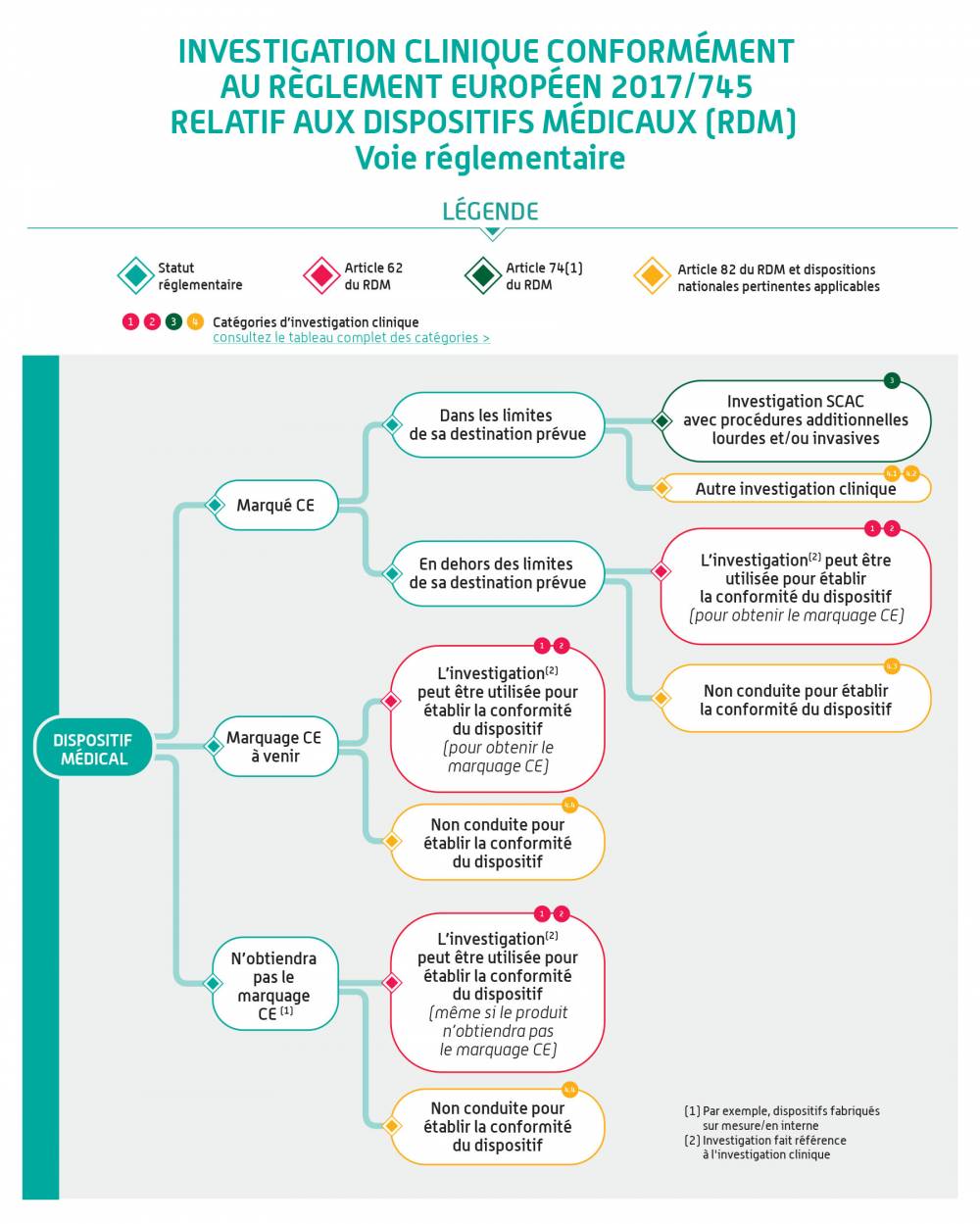
En fonction de la classe du dispositif à évaluer dans l’investigation clinique et du fait qu’il porte ou non le marquage CE, ce règlement prévoit plusieurs types d’investigations cliniques. De façon générale, les investigations cliniques font l’objet d’un examen scientifique et éthique (article 62.3) et ne peuvent être mises en œuvre qu’en l’absence d’un avis défavorable émis par un comité d’éthique.
Ce règlement vise à renforcer et harmoniser, dans l’Union européenne, l’ensemble de la réglementation relative aux dispositifs médicaux ; son chapitre VI est tout particulièrement dédié à l’évaluation clinique et aux investigations cliniques. Il a été publié dans le Journal du Parlement européen en 2017 et est applicable à partir du 26 mai 2021 pour les éléments liés aux CI. Le RDM a introduit un certain nombre de changements relatifs à l'examen éthique et scientifique des IC proposées.
Le règlement prévoit le fonctionnement d'une base de données électronique sous-tendant un certain nombre de fonctions dans le cadre du règlement 2017/745 en Europe connue sous le nom de «Eudamed». La Commission européenne a indiqué que certains modules d'Eudamed et notamment celui portant sur les investigations cliniques ne seront pas fonctionnels avant 2028. Ainsi dans l’attente, le guide MDCG 2021-1 renvoie aux procédures nationales pour les soumissions des investigations cliniques et les notifications des évènements indésirables graves. Pour la France, les soumissions se font par mail auprès de l’ANSM et sur le SI RIPH (site CNRIPH) pour les comités d’éthique.
Quant aux projets de recherche soumis pour évaluation avant le 26 mai 2021, ils relèvent du cadre de la loi Jardé pour l’évaluation du dossier initial et des éventuelles modifications substantielles. Cependant, à partir du 26 mai 2021, les modalités de signalements de vigilance relèvent du règlement DM.
En fonction de la classe du dispositif à évaluer dans l’investigation clinique et du fait qu’il porte ou non le marquage CE, ce règlement prévoit plusieurs types d’investigations cliniques. De façon générale, les investigations cliniques font l’objet d’un examen scientifique et éthique (article 62.3) et ne peuvent être mises en œuvre qu’en l’absence d’un avis défavorable émis par un comité d’éthique.
Ce règlement vise à renforcer et harmoniser, dans l’Union européenne, l’ensemble de la réglementation relative aux dispositifs médicaux ; son chapitre VI est tout particulièrement dédié à l’évaluation clinique et aux investigations cliniques. Il a été publié dans le Journal du Parlement européen en 2017 et est applicable à partir du 26 mai 2021 pour les éléments liés aux CI. Le RDM a introduit un certain nombre de changements relatifs à l'examen éthique et scientifique des IC proposées.
Le règlement prévoit le fonctionnement d'une base de données électronique sous-tendant un certain nombre de fonctions dans le cadre du règlement 2017/745 en Europe connue sous le nom de «Eudamed». La Commission européenne a indiqué que certains modules d'Eudamed et notamment celui portant sur les investigations cliniques ne seront pas fonctionnels avant 2028. Ainsi dans l’attente, le guide MDCG 2021-1 renvoie aux procédures nationales pour les soumissions des investigations cliniques et les notifications des évènements indésirables graves. Pour la France, les soumissions se font par mail auprès de l’ANSM et sur le SI RIPH (site CNRIPH) pour les comités d’éthique.
Quant aux projets de recherche soumis pour évaluation avant le 26 mai 2021, ils relèvent du cadre de la loi Jardé pour l’évaluation du dossier initial et des éventuelles modifications substantielles. Cependant, à partir du 26 mai 2021, les modalités de signalements de vigilance relèvent du règlement DM.
À retenir
Recommandation concernant les modifications substantielles
Aucune demande de MS (Modification substantielle) ne peut être déposée par le promoteur tant que les procédures d'évaluation d'investigation clinique ne sont pas finalisées auprès de chacune des entités ANSM (avec une décision d'autorisation) et CPP (avec une décision d'avis favorable).Recommandations concernant les recherches mixtes
Ce document, établi en concertation avec les représentants des comités de protection des personnes, l’Agence national de sécurité du médicament et le ministère de la santé reprend les différentes recommandations relatives au dépôt et à l’évaluation des dossiers de demande de recherche associant un médicament à un dispositif médical ou un dispositif médical de diagnostic in vitro.
Cette démarche concerne les dispositifs médicaux et les dispositifs sans finalité médicale relevant de l'annexe XVI du règlement (EU) 2017/745.
En savoir plus sur la qualification et classification des DM et DMDIV
Dispositions générales
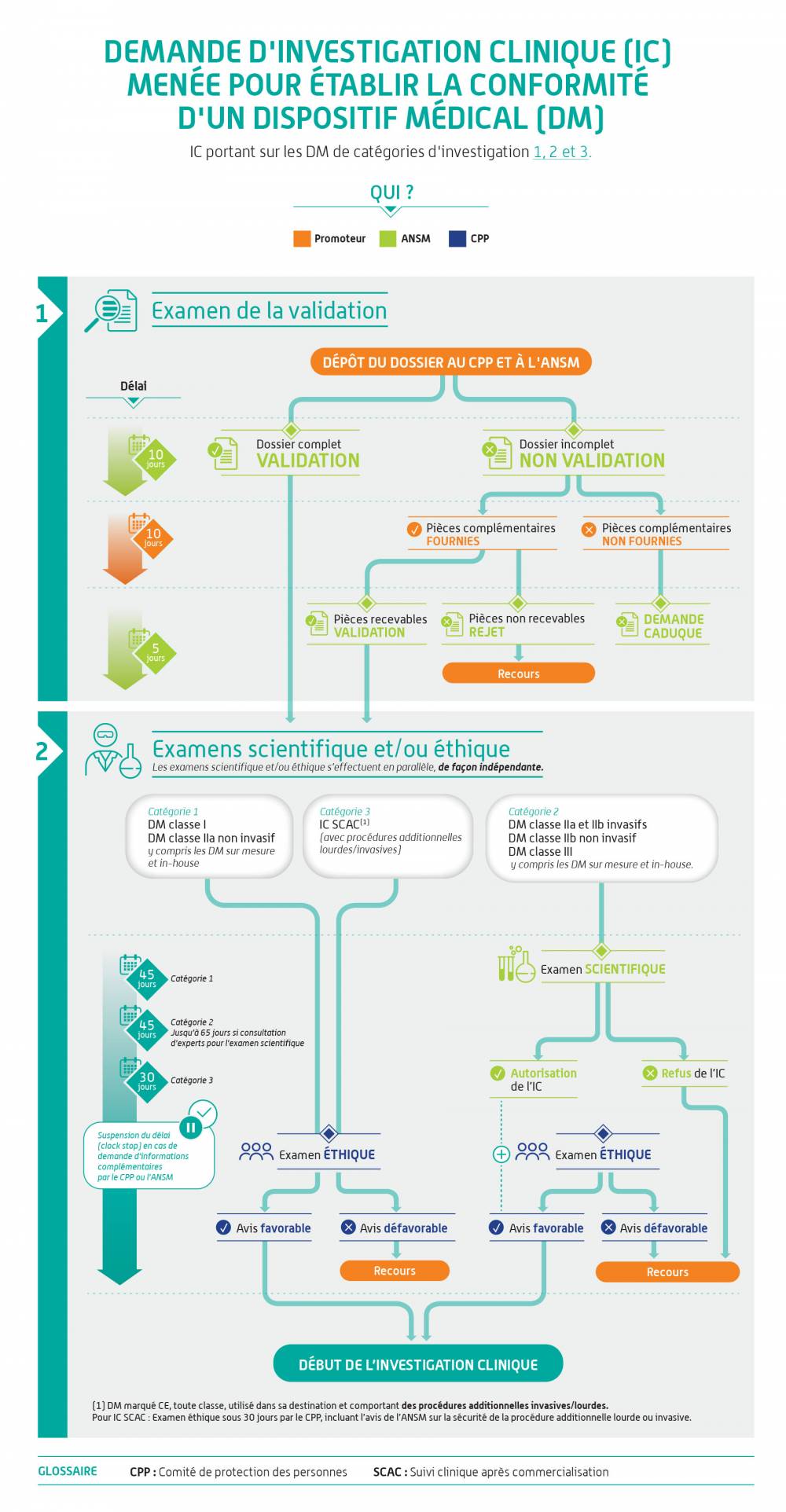
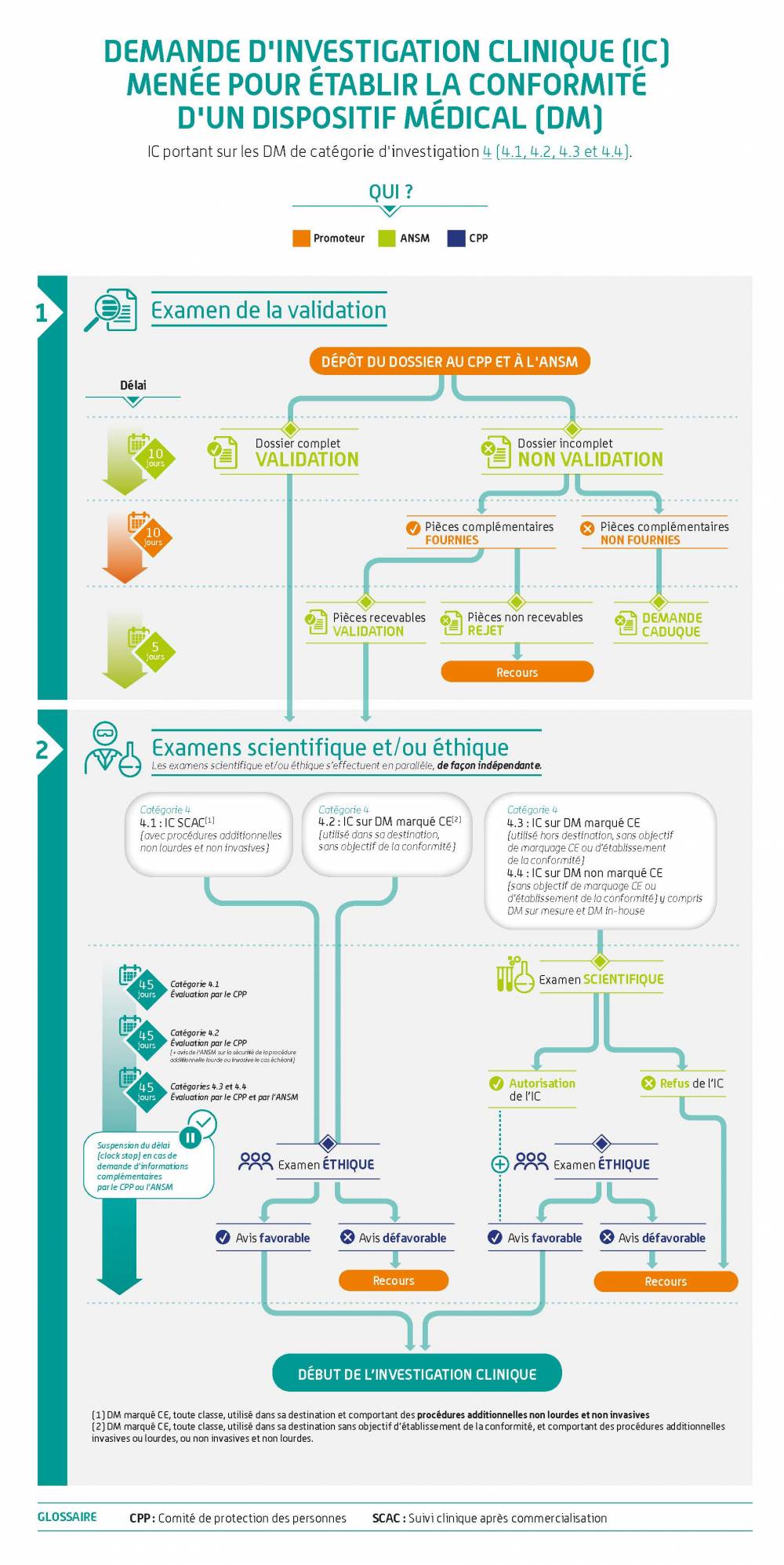
Avis aux promoteurs (IC déposées à partir du 26 mai 2021) – Partie I
Demande de mise en œuvre d’une investigation clinique
L’ANSM recommande aux fabricants de dispositifs implantables de solliciter, via le guichet innovation et orientation de l’ANSM, un avis scientifique 6 à 12 mois avant le dépôt de leur demande d’investigation clinique afin de faciliter son examen et d’échanger sur les exigences notamment concernant le développement pré-clinique de leur DM.Comment soumettre et comment est traitée ma demande ?
Avis aux promoteurs (IC déposées à partir du 26 mai 2021) – Partie II
Ces infographies illustrent la démarche pour les dispositifs médicaux. Elle s'applique de la même façon aux dispositifs sans finalité médicale relevant de l'annexe XVI du règlement (EU) 2017/745.
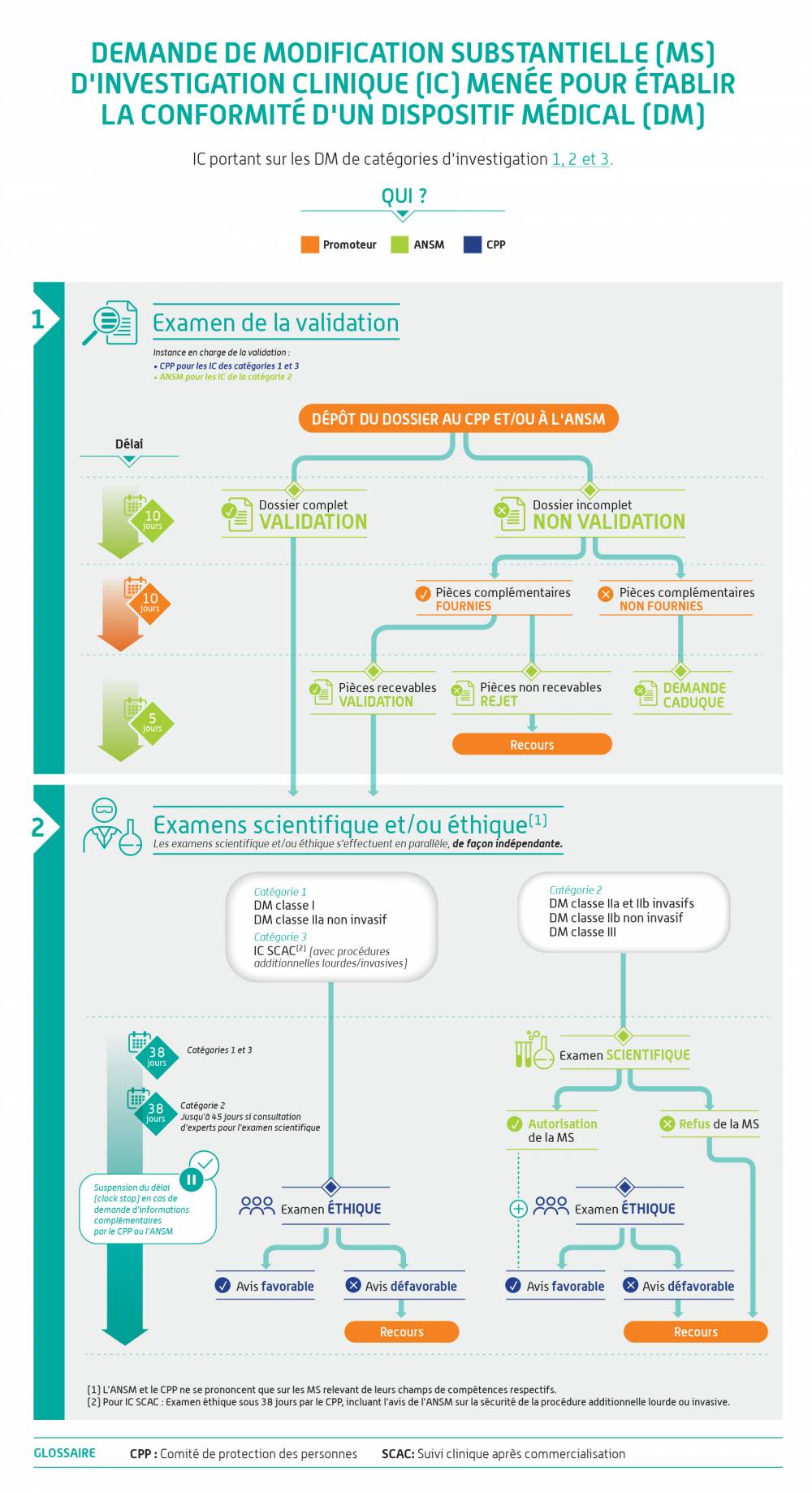
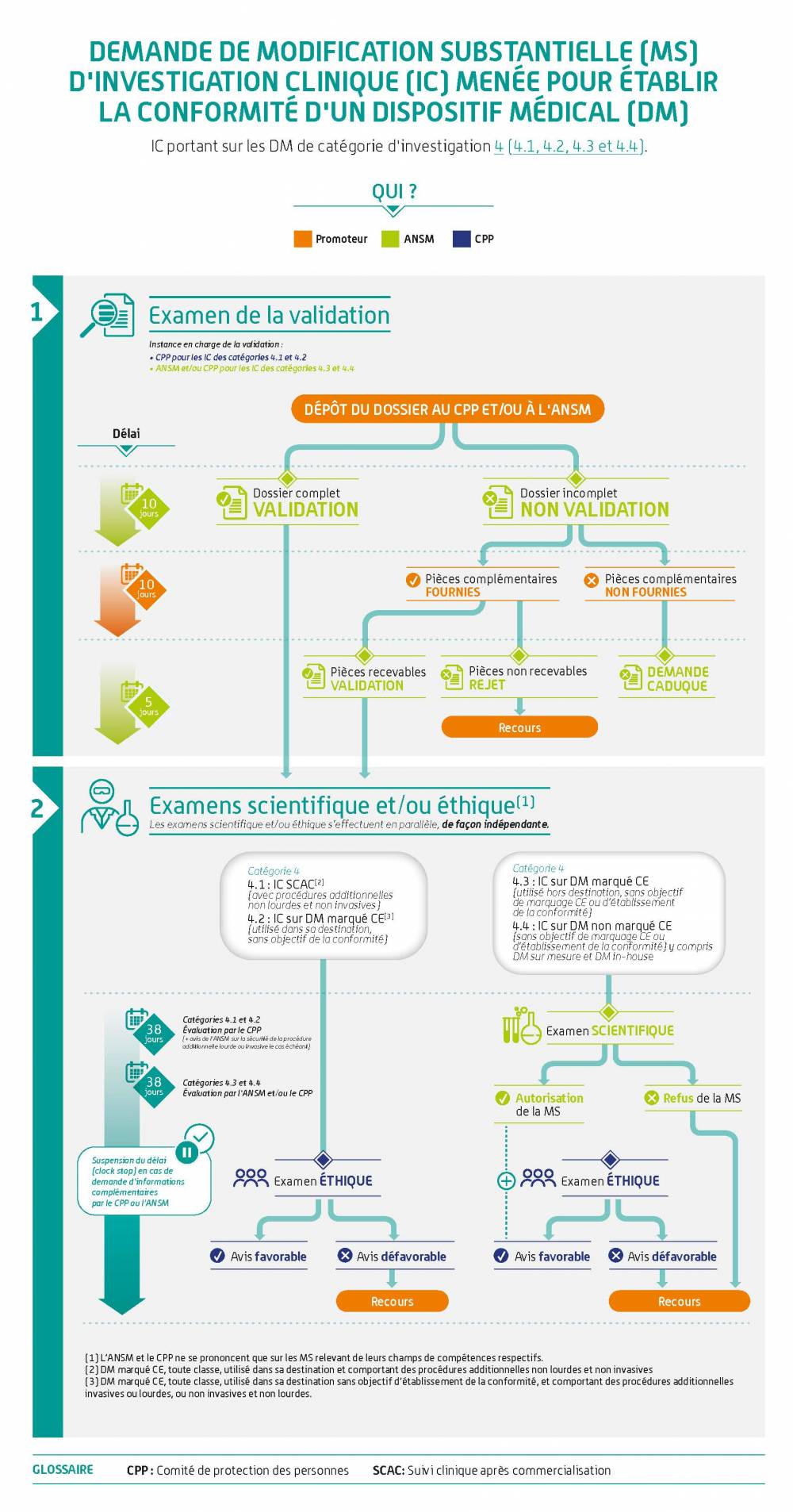
Demande de modification substantielle et autres modifications
| Aucune demande de MS (Modification Substantielle) ne peut être déposée par le promoteur tant que les procédures d'évaluation d'Investigation clinique ne sont pas finalisées auprès de chacune des entités ANSM (avec une décision d'autorisation) et CPP ( avec une décision d'avis favorable). |
Comment soumettre et comment est traitée ma demande ?
Avis aux promoteurs (IC déposées à partir du 26 mai 2021) – Partie III
Le formulaire de demande à utiliser quel que soit le régime de l’IC :
Ces infographies illustrent la démarche pour les dispositifs médicaux. Elle s'applique de la même façon aux dispositifs sans finalité médicale relevant de l'annexe XVI du règlement (EU) 2017/745.
NB : pour les modalités pratiques relatives aux investigations cliniques déposées avant le 26 mai 2021, se reporter à l’avis aux promoteurs correspondant figurant dans la rubrique dispositions générales ; toutefois, le formulaire de demande est identique pour tous les IC
Avis aux promoteurs (RIPH1 déposées avant le 26 mai 2021) - Partie I
Fin d’investigation
Avis aux promoteurs (IC déposées à partir du 26 mai 2021) – Partie V (à venir)
Le formulaire de déclaration à utiliser :
NB : Ce formulaire de fin d’investigation est à utiliser pour tous les IC relevant du RDM et pour les RIPH1 se poursuivant après le 26 mai 2021.
En son absence, le CIR et le SCIR référencés par le promoteur selon les modalités décrites dans le guide MDCG 2024-15 sont adressés par les promoteurs à l’ANSM en vue de leur stockage dans un répertoire CIRCABC public dédié intitulé « MDR Clinical Investigation reports and their summaries » (rapports d'investigation clinique et leurs résumés), accessible via ce lien.
Publication des rapports d'investigations cliniques
Conformément aux dispositions du RDM (article 77 paragraphes 5 et 7), les promoteurs ont l’obligation de soumettre aux États membres dans lesquels une investigation clinique a été menée un rapport d'investigation clinique (CIR), ainsi qu’un résumé (SCIR) aisément compréhensible pour l'utilisateur visé. Le rapport et le résumé sont soumis par l'intermédiaire d'EUDAMED.En son absence, le CIR et le SCIR référencés par le promoteur selon les modalités décrites dans le guide MDCG 2024-15 sont adressés par les promoteurs à l’ANSM en vue de leur stockage dans un répertoire CIRCABC public dédié intitulé « MDR Clinical Investigation reports and their summaries » (rapports d'investigation clinique et leurs résumés), accessible via ce lien.
Cette infographie illustre la démarche pour les dispositifs médicaux. Elle s'applique de la même façon aux dispositifs sans finalité médicale relevant de l'annexe XVI du règlement (EU) 2017/745.