PUBLIÉ LE 18/12/2023
- MIS À JOUR LE 12/06/2025
Progestatifs et risque de méningiome : recommandations pour limiter ce risque
| Actualisation du 04/06/2024 |
Lors de sa séance du 11 octobre 2023, le comité scientifique temporaire (CST) d’experts qui nous accompagne dans le suivi du risque de méningiome associé aux traitements progestatifs a confirmé que les mesures de réduction de ce risque en cas d’utilisation de médrogestone (Colprone) et d’acétate de médroxyprogestérone (Depo Provera) doivent être similaires aux mesures adoptées pour l’acétate de chlormadinone (Lutéran et génériques) et de nomégestrol (Lutényl et génériques) dans la mesure où les niveaux de risque de méningiome sont comparables.
S’agissant de la promégestone (Surgestone), dont la commercialisation a cessé depuis 2020, des mesures spécifiques concernent les femmes traitées avec ce médicament.
Nous avons suivi l’avis du comité pour élaborer des recommandations d’utilisation et de suivi des femmes traitées par ces médicaments ainsi que des recommandations générales sur les progestatifs, notamment en cas de changement de traitement entre progestatifs.
En complément de ces recommandations, nous portons ce dossier à la connaissance de l’Agence européenne du médicament.
En juillet 2023, nous avons formulé de premières recommandations d’utilisation et de suivi des personnes traitées par médrogestone (Colprone), médroxyprogestérone (Depo Provera). Ces recommandations faisaient suite aux résultats d’une étude épidémiologique du GIS EPI-PHARE qui montrait une augmentation du risque de méningiome associé à l’exposition à ces médicaments et confirmait à nouveau le surrisque de méningiome associé à la prise prolongée d’acétate de nomégestrol (Lutényl et génériques), chlormadinone (Lutéran et génériques) et cyprotérone (Androcur et génériques).A contrario, pour les médicaments à base de progestérone (Utrogestan et génériques), de dydrogestérone (Duphaston) et les dispositifs intra-utérins, dits « stérilets », au lévonorgestrel (Mirena, Donasert, Kyleena et Jaydess), les résultats ne montraient pas de surrisque de méningiome.
Pour les autres progestatifs utilisés seuls (diénogest (Visanne et génériques), drospirénone (Slinda) et désogestrel (Cérazette et génériques)) l’étude épidémiologique n’a pas pu étudier le risque de méningiome, par limite méthodologique et antériorité insuffisante dans les bases de remboursement de l’Assurance Maladie. Pour ces progestatifs, le risque de méningiome n’est donc pas connu et ne peut être exclu à ce jour. Des études complémentaires sur le risque de méningiome associé à ces progestatifs sont nécessaires notamment au regard de leur utilisation croissante.
Comme cela avait été annoncé, les sociétés savantes de gynécologie (Collège national des gynécologues et obstétriciens (CNGOF) et Société française de gynécologie (SFG)) ont été auditionnées le 11 octobre 2023 par le CST, afin notamment d’affiner les recommandations émises en juillet 2023.
Le comité s’est prononcé en faveur du maintien des premières recommandations, en y ajoutant des précisions sur les changements de progestatifs.
Médrogestone (Colprone) et acétate de médroxyprogestérone (Depo Provera)
Recommandations d’utilisation pour les personnes traitées
Médrogestone (Colprone)Elle ne doit pas être utilisée en première intention dans les indications suivantes :
- Ménopause, cycle artificiel en association avec un œstrogène ;
- Irrégularités du cycle ;
- Syndrome prémenstruel (dysménorrhées essentielles) ;
- Douleur mammaire (mastodynie) non sévère.
- Saignements liés au fibrome ;
- Endométriose ;
- Douleur mammaire (mastodynie) sévère.
Il doit être utilisé lorsqu’il n’est pas possible d’utiliser d’autres méthodes contraceptives, comme le précise son autorisation de mise sur le marché.
Les médecins du CST ont estimé que sa prescription peut rester justifiée dans certains cas très particuliers, tels que non-respect de l’observance, intolérance à l’implant sous cutané ou au dispositif intra-utérin (DIU).
Recommandations de suivi par imagerie pour les personnes traitées
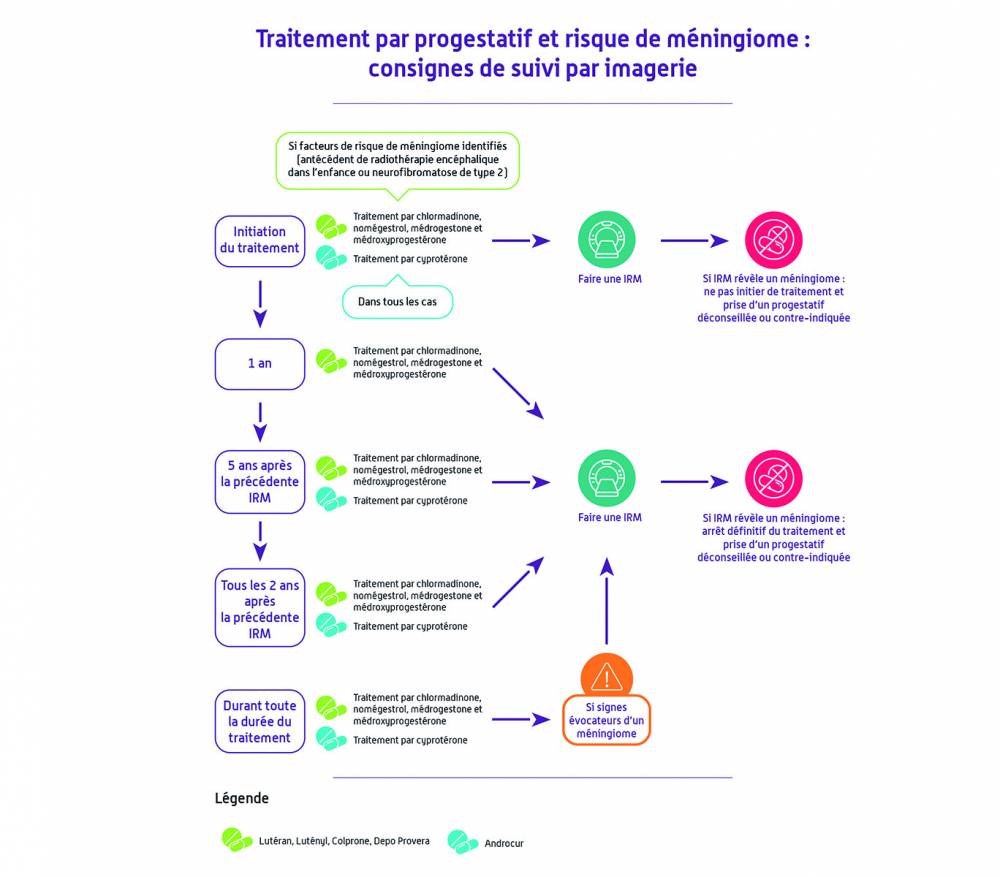
Pour la médrogestone et l’acétate de médroxyprogestérone, une surveillance par imagerie cérébrale est désormais recommandée selon les mêmes modalités que pour l’acétate de chlormadinone (Lutéran et génériques) ou de nomégestrol (Lutényl et génériques) : Un examen par imagerie cérébrale (IRM) doit être également réalisé quel que soit l'âge de la patiente :- A tout moment pendant ou après le traitement en cas de signes évocateurs de méningiomes.
- A l’instauration d’un traitement progestatif par l’un des 5 progestatifs à risque (acétate de cyprotérone, acétate de chlormadinone, acétate de nomégestrol, médrogestone, acétate de médroxyprogestérone) ou par un progestatif avec un risque de méningiome non connu à ce jour (diénogest, drospirénone et désogestrel), si la patiente a été traitée plus d'un an par médrogestone ou médroxyprogestérone (voir également recommandations générales sur les progestatifs ci-dessous).
Surgestone (promégestone), progestatif qui n’est plus commercialisé depuis 2020
Recommandations de suivi par imagerie pour les patientes qui ont été traitées
- Si la patiente a été traitée plus d’un an et qu’elle a ensuite été traitée par un des 5 progestatifs à risque (acétate de cyprotérone, acétate de chlormadinone, acétate de nomégestrol, médrogestone, acétate de médroxyprogestérone) ou par un progestatif avec un risque de méningiome non connu à ce jour (diénogest, drospirénone et désogestrel), une IRM cérébrale doit être réalisée.
- Si la patiente présente des signes évocateurs d’un méningiome, même à distance de l’arrêt de son traitement par promégestone, une IRM cérébrale doit être réalisée.
Recommandations générales d’utilisation des progestatifs et de changement de traitement entre progestatifs
- En cas d’antécédent de méningiome ou de méningiome existant, la mise en place d’un traitement par l’un des 5 progestatifs (acétate de cyprotérone, acétate de chlormadinone, acétate de nomégestrol, médrogestone, acétate de médroxyprogestérone) à risque de méningiome est contre-indiquée.
Pour les autres progestatifs (seuls, en association dans un contraceptif ou un Traitement Hormonal Substitutif de la ménopause) il est recommandé de ne pas les utiliser.
Dans des situations exceptionnelles la prescription d’un traitement progestatif est possible après évaluation en réunion de concertation pluridisciplinaire (RCP), constituée de gynécologue et/ou endocrinologue et neurochirurgien, sur la base du rapport bénéfice/risque individuel pour la patiente et de l’existence ou non d’alternatives thérapeutiques. - La prescription d’un nouveau progestatif en relai d’un traitement antérieur par acétate de cyprotérone, acétate de chlormadinone, acétate de nomégestrol, médrogestone, médroxyprogestérone ou promégestone n’exclut pas le risque de méningiome, sans que l’on puisse actuellement le déterminer.
En cas d’utilisation supérieure à un an d’un de ces progestatifs et de changement de traitement vers un progestatif à risque ou vers un progestatif avec un risque de méningiome non connu à ce jour, une IRM cérébrale doit être réalisée à l’instauration du nouveau traitement progestatif. - En cas de changement de traitement pour un progestatif non associé à un risque de méningiome (dispositif intra utérin - DIU - au lévonorgestrel, progestérone par voie orale, vaginale ou cutanée, dydrogestérone) une IRM sera réalisée si des signes évocateurs d’un méningiome apparaissent.
- Le traitement doit toujours être prescrit à la dose minimale efficace et pendant une durée d’utilisation la plus courte possible.
- L’intérêt de poursuivre le traitement doit être réévalué chaque année, notamment aux alentours de la ménopause, car le risque de méningiome augmente fortement avec l’âge.
- Une IRM cérébrale doit être réalisée en cas de signes évocateurs d’un méningiome.
Mesures de réduction du risque et actions à venir
Comme à chaque fois qu’un traitement progestatif a été associé à une augmentation de risque de méningiome, les mesures suivantes seront prises :- Renforcement des conditions de prescription et de délivrance de médrogestone (Colprone) et médroxyprogestérone (Depo Provera) avec mise en place d’une attestation annuelle d’information dès lors que le traitement est poursuivi au-delà d’un an et remise d’une fiche d’information patiente par le prescripteur (quelle que soit la durée du traitement).
- Envoi de courriers nominatifs aux patientes et aux prescripteurs ayant respectivement eu une délivrance ou prescrit de la médrogestone (Colprone) et de la médroxyprogestérone (Depo Provera) dans les 24 derniers mois.