Assurer la disponibilité
La sécurisation de l’approvisionnement en médicaments d’intérêt thérapeutique majeur
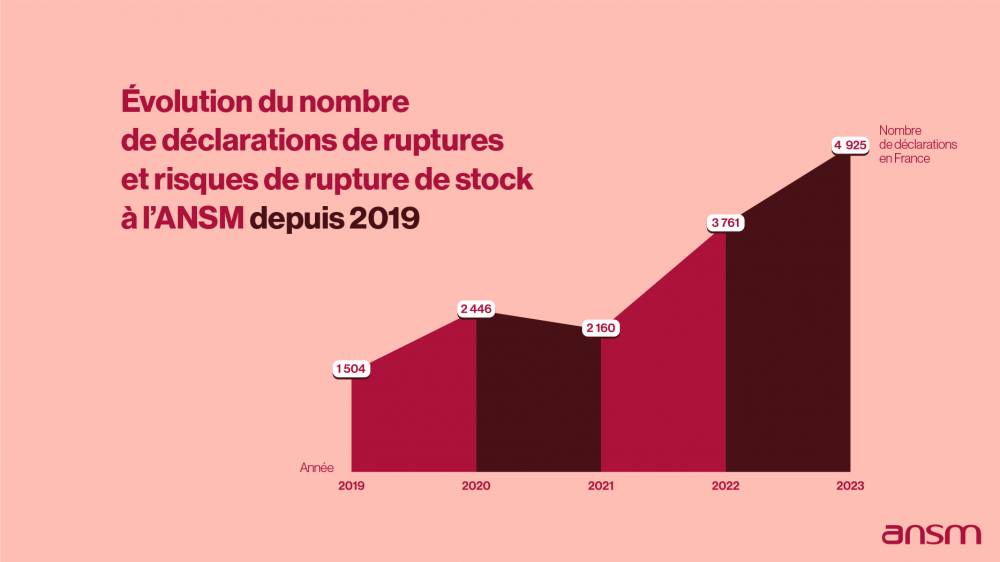
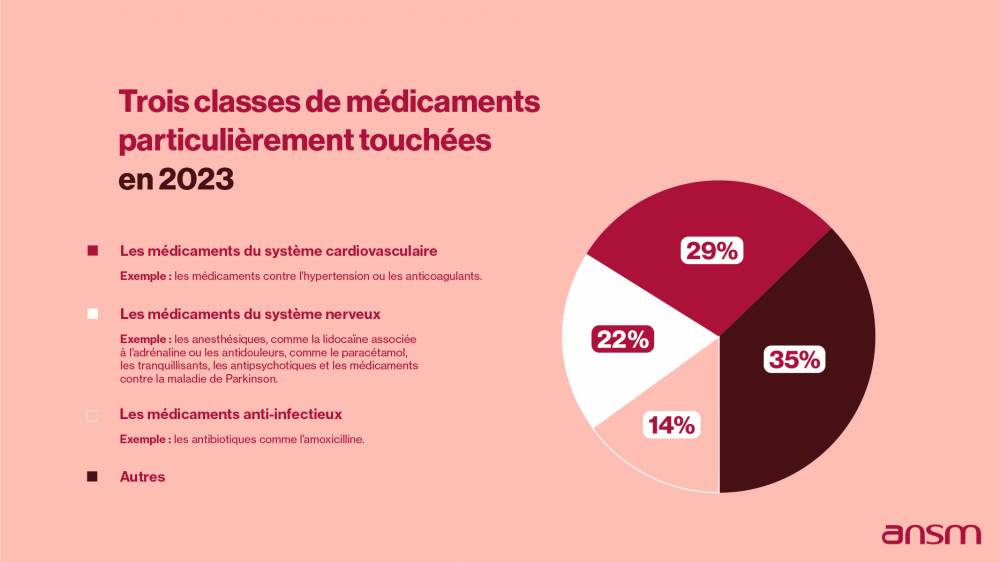
L’ANSM veille à la disponibilité des médicaments « essentiels » appelés MITM (médicaments d'intérêt thérapeutique majeur) ou ceux dont l'indisponibilité peut entraîner un risque de santé publique.Elle évalue, valide et coordonne, si nécessaire, les actions qui doivent être menées par les laboratoires pharmaceutiques afin de sécuriser l’accès à ces médicaments pour les patients. En effet, les laboratoires pharmaceutiques sont responsables de la disponibilité des médicaments qu’ils commercialisent.
Pour en savoir plus :
La sécurisation de l’approvisionnement des dispositifs médicaux et des dispositifs médicaux de diagnostic in vitro (DM et DMDIV)
Dans le cadre de notre mission de surveillance du marché, nous remplissons, en tant qu’autorité compétente, un rôle prépondérant dans l’accès et la disponibilité des dispositifs médicaux et dispositifs médicaux de diagnostic in vitro, afin que les soins les plus adaptés soient assurés aux patients, en évitant notamment une désorganisation des services hospitaliers.Les ruptures, risques de ruptures ou arrêts de commercialisation peuvent être la conséquence, par exemple, d’obstacles dans la fabrication, de défaut d’approvisionnement en matières premières, de difficultés dans la chaine de distribution ou encore d’une cause règlementaire ou tout simplement d’orientations industrielles et commerciales.
En juin 2024, les règlements européens 2017/745 et 2017/746 respectivement relatifs aux dispositifs médicaux et dispositifs médicaux de diagnostic in vitro ont été amendés. Ils mettent notamment en place, à destination des fabricants, un mécanisme européen et obligatoire d'information anticipée, dans certaines situations d'arrêts de commercialisation ou de ruptures (temporaires) de DM et de DMDIV.
En application de l’article 10 bis des règlements précités, un fabricant qui anticipe une interruption (temporaire) ou une cessation de fourniture (arrêt de commercialisation définitif), susceptible d’entrainer un préjudice grave ou un risque de préjudice grave pour les patients ou la santé publique, en informe notamment l’ANSM, au moins 6 mois avant l’effectivité de l’interruption ou de la cessation.
Depuis septembre 2021, nous avions mis en place un cadre spécifique à la France, qui avait fait l’objet d’ajustements opérationnels et de fond en 2024. Ce cadre, qui reposait sur une application volontaire et facultative des opérateurs dans l’intérêt des patients, proposait des outils et des modalités nationales de gestion des situations d’indisponibilité qui étaient de nature à créer un risque de santé publique et/ou dans la prise en charge de l’état de santé du patient.
Les grilles d’analyse de risque créées dans ce contexte restent à disposition des opérateurs et constituent pour eux un outil utile, pragmatique et homogène pour évaluer la criticité d’une situation. Les situations potentiellement critiques qui n’auraient pas fait l’objet d’une déclaration au titre des dispositions européennes obligatoires peuvent sur cette base continuer à faire l’objet d’une information de l’ANSM.
Le principe de ces outils est la circulation anticipée de l’information et la gestion de ces situations par les opérateurs du marché.
La gestion des défauts qualité
L’ANSM réalise le traitement et l’évaluation de l’ensemble des signalements de défauts qualité des médicaments qui lui sont transmis par les laboratoires pharmaceutiques. Ces défauts qualité peuvent notamment survenir lors de la fabrication des médicaments et/ou des substances actives.En fonction de différents critères et en prenant toujours en considération le risque patient associé, un traitement adapté à chaque signalement est réalisé.
Plusieurs mesures peuvent être mises en œuvre :
- Rappel de lots : dans les cas notamment de défauts de stabilité, de contaminations croisées ou de non-conformités aux spécifications des produits. Le rappel de lots est alors réalisé par le laboratoire, en concertation avec l’ANSM.
- Mise en quarantaine : lorsque des lots encore non distribués sont concernés par un défaut qualité, leur mise en quarantaine peut être demandée en attendant les résultats des investigations.
- Alertes aux utilisateurs potentiels : en cas de nécessité, l’ANSM peut diffuser une alerte aux patients et aux professionnels de santé.
- “RapidAlerts” Défauts Qualité : l’ANSM peut émettre des “RapidAlerts” Défauts Qualité pour informer les autorités compétentes des autres pays.