Encadrer l'accès précoce aux produits de santé
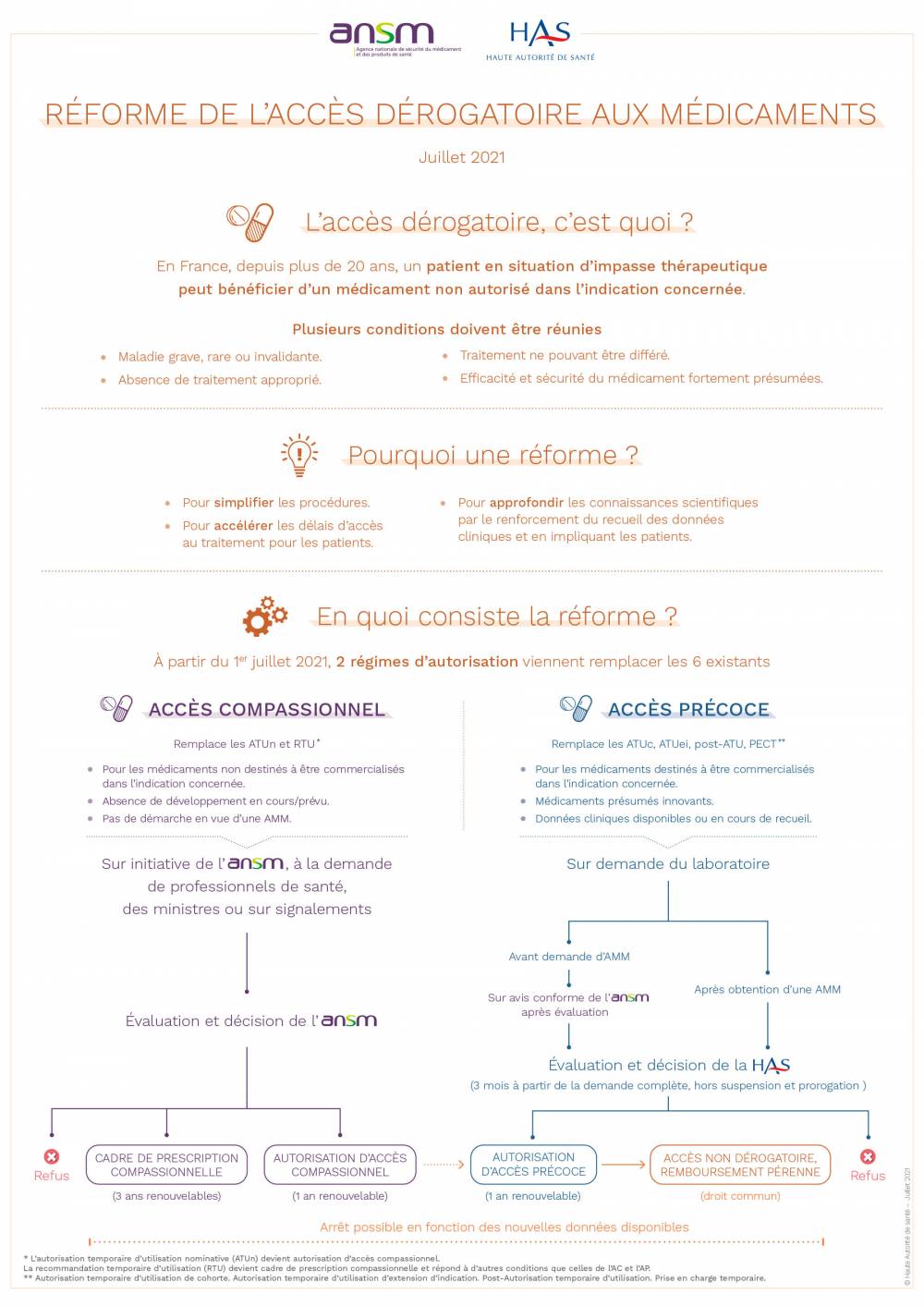
Afin d’offrir aux patients un accès rapide aux innovations représentant une avancée thérapeutique majeure ou répondant à un besoin médical non couvert, différentes procédures nous permettent d’encadrer et d’accompagner la mise à disposition de produits innovants en toute sécurité. Entrée en vigueur le 1er juillet 2021, la réforme de l’accès dérogatoire aux médicaments a simplifié le dispositif en mettant en place 2 régimes au lieu des 6 existants jusqu’à alors.
Les avis scientifiques
En tant qu’agence d’expertise, l’ANSM peut rendre des avis scientifiques, sur sollicitation de laboratoires pharmaceutiques ou de fabricants de dispositifs médicaux. Ces avis s’appuient sur les spécificités du produit en cours de développement ainsi que sur les connaissances les plus récentes en termes de maladies, de populations cibles et de traitements existants. En apportant un éclairage sur la stratégie générale de développement d’un produit, notamment sur les types d’essais cliniques à mener, ces avis permettent d’accompagner les innovations en conformité avec le cadre réglementaire.Les autorisations d’accès compassionnel et d’accès précoce
Lorsqu’un médicament ne dispose pas d’autorisation de mise sur le marché (AMM) en France, l’ANSM peut autoriser exceptionnellement l’usage de ce médicament si elle considère que le bénéfice présumé est supérieur au risque. Cette procédure exceptionnelle et dérogatoire n’est applicable qu’en l’absence d’alternative thérapeutique appropriée.Les autorisations peuvent être d’accès compassionnel (AAC) ou d’accès précoce (AAP)
Les AAC sont délivrées par l’ANSM, sur demande d’un médecin ou d’une institution sanitaire pour un patient nommément désigné. Elles concernent des médicaments non destinés à être commercialisés pour l’indication concernée, ne faisant l’objet ni de développement en cours ni d’une demande d’AMM. Elles sont d’une durée d’1 an renouvelable.Les AAP sont délivrées par la Haute autorité de la santé (HAS), sur demande d’un laboratoire. Dans ce dernier cas, le médicament peut être prescrit à un groupe de patients traités et surveillés suivant des critères définis dans un protocole d'utilisation thérapeutique (PUT) et de recueil des données (RD).
Si la demande d’AAP intervient avant celle de l’AMM, elle ne peut être délivrée qu’après évaluation et avis conforme de l’ANSM. Si la demande d’AAP intervient après l’obtention de l’AMM, la HAS procède directement à l’évaluation et à la prise de décision.
Le cadre de prescription compassionnelle
Lorsqu’un médicament dispose déjà d’une AMM pour une ou plusieurs indications données, mais qu’il est utilisé en pratique pour d’autres situations, l’ANSM peut établir un cadre de prescription compassionnelle (CPC) pour une durée de 3 ans renouvelables.Un CPC ne peut être délivré qu’à condition que le besoin thérapeutique ne soit pas déjà couvert par un autre traitement et que les données scientifiques permettent de considérer la balance bénéfice/risque favorable pour les patients concernés.
Dérogation pour les dispositifs médicaux
Un système de dérogation s’applique aux dispositifs médicaux, permettant un usage exceptionnel en l’absence de marquage CE, cette mise sur le marché d’un dispositif n’ayant pas été soumis à la procédure de marquage CE peut être possible dans certaines situations particulières et dans l’intérêt des patients.Le Guichet Innovation et Orientation
Nous avons créé le Guichet Innovation et Orientation en 2020 pour faciliter les échanges avec les acteurs de l’innovation (industriels, académiques, start-up) menant un projet de développement d’un produit de santé. Il s’agit d’une plate-forme d’échange dématérialisée qui permet aux utilisateurs d’exprimer des demandes d’avis ou de rencontres sur des questions scientifiques, techniques ou réglementaires dans un cadre harmonisé respectant les obligations déontologiques.Accompagnement sur un projet de développement d’un dispositif médical ou d’un dispositif de diagnostic in vitro
L’ANSM renforce et facilite l’accompagnement à l’innovation ou de développement en cours de porteurs de projet. Elle permet une meilleure compréhension et lisibilité du cadre réglementaire applicable aux DM et DMDIV et des processus liés et in fine, le développement de produits conformes aux exigences de qualité et de sécurité pour les patients.Dans ce cadre, l’ANSM intervient :
- pour donner un avis sur la qualification et classification de DM ;
- pour donner un avis scientifique sur les exigences applicables et la recherche clinique ;
- dans le cadre de la pré-soumission d’investigation clinique ou d’étude de performance.