Médicaments princeps
Qu'est-ce qu'un médicament princeps ?
Un produit est qualifié de médicament s’il possède des propriétés curatives ou préventives à l’égard des maladies humaines ou animales, ou s'il peut être utilisé ou administré en vue d’établir un diagnostic médical.Un médicament dit « princeps » ou spécialité de référence est le médicament d'origine à partir duquel sont conçus les médicaments génériques. Il est composé d’un ou plusieurs principes actifs ou « substances actives », responsable(s) de son effet thérapeutique, et d’excipients. Les principes actifs demeurent inchangés dans les médicaments génériques, seuls les excipients peuvent être modifiés par rapport à ceux du princeps.
Principe actif et excipients
Le principe actif est la molécule du médicament lui conférant ses propriétés curatives ou préventives.L’excipient désigne toute substance autre que le principe actif présente dans un médicament. Il n'a aucune activité pharmacologique recherchée. Les excipients servent à faire parvenir le principe actif dans l’organisme à l’endroit où il doit agir. Ils ont un rôle dans l’absorption et la stabilité du médicament. Ils permettent ainsi une dissolution correcte. Ils conditionnent son aspect, sa couleur et son goût.
Certains excipients sont dits "à effets notoires" car ils présentent un risque accru de mauvaise tolérance chez des patients sensibles. L’aspartam, par exemple, est une source de phénylalanine, il est donc contre-indiqué chez les personnes souffrant de phénylcétonurie.
La présence des excipients à effets notoires est indiquée dans la notice et sur la boite du médicament (princeps et générique). Les informations sur les excipients de tous les médicaments commercialisés en France sont consultables sur la base de données publique des médicaments.
Les médicaments qui en contiennent doivent être utilisés avec précautions par certains patients, plus sensibles. (Article R5121-1 8° du CSP)
Les excipients à effet notoire sont listés dans une ligne directrice européenne.
Conditions de prescription et délivrance
En France, aucun médicament ne peut être vendu au public en dehors des pharmacies de ville ou d’hôpital (pharmacie à usage intérieur, PUI).- Les médicaments à "prescription médicale facultative" (PMF) ou "non listés" peuvent être vendus sans ordonnance.
- Les médicaments à "prescription médicale obligatoire" (PMO) dont l’utilisation nécessite une surveillance particulière du patient, ou qui présentent des risques d’effets indésirables potentiellement sérieux ne peuvent être obtenus que sur ordonnance.
- Certains médicaments sont inscrits sur la liste des médicaments stupéfiants : leur délivrance est sécurisée (ordonnance infalsifiable), car soumise à des règles très strictes, et la quantité délivrée par le pharmacien est limitée à 7, 14 ou 28 jours de traitement, suivant la nature du médicament.
- Certains médicaments sont à prescription restreinte.
Pour en savoir plus sur la vente en ligne de médicaments
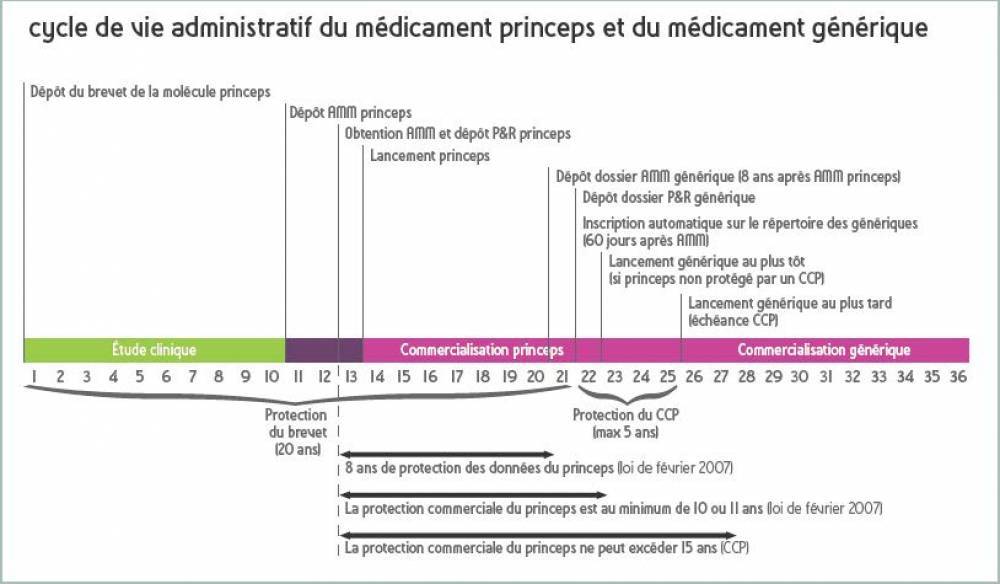
La protection de la propriété intellectuelle, assurée par le dépôt de brevets, permet au laboratoire de tirer les bénéfices des investissements inhérents au développement de médicaments princeps. C’est la protection commerciale :
Protection administrative des données et protection du brevet
La protection administrative des données est la protection des études versées à l’appui du dossier d’autorisation de mise sur le marché (AMM) du médicament princeps. Elle varie en fonction de la date de dépôt du dossier princeps :- 10 ans en France pour les dossiers princeps déposés avant le 30/10/2005 ;
- 8 ans en France (et dans tous les états membres de l'UE) pour les dossiers princeps déposés après le 30/10/2005.
La protection de la propriété intellectuelle, assurée par le dépôt de brevets, permet au laboratoire de tirer les bénéfices des investissements inhérents au développement de médicaments princeps. C’est la protection commerciale :
- de 10 ou 11 ans à partir de la date d’AMM ;
- jusqu’à 15 ans dans les cas de certificat complémentaire de protection (CCP) à partir de la première AMM délivrée dans l’union européenne.