Médicaments génériques
Qu'est ce qu'un médicament générique ?
Un médicament générique :
- est conçu à partir de la molécule d’un médicament déjà autorisé (appelé spécialité de référence, médicament d’origine ou princeps) dont le brevet est tombé dans le domaine public ;
- doit avoir la même composition qualitative et quantitative en principes actifs ainsi que la même forme pharmaceutique que le princeps et démontrer qu’il a la même efficacité thérapeutique (même biodisponibilité) ;
- est soumis aux mêmes conditions de prescription que les médicaments princeps
Bénéfice du recul sur le médicament d’origine
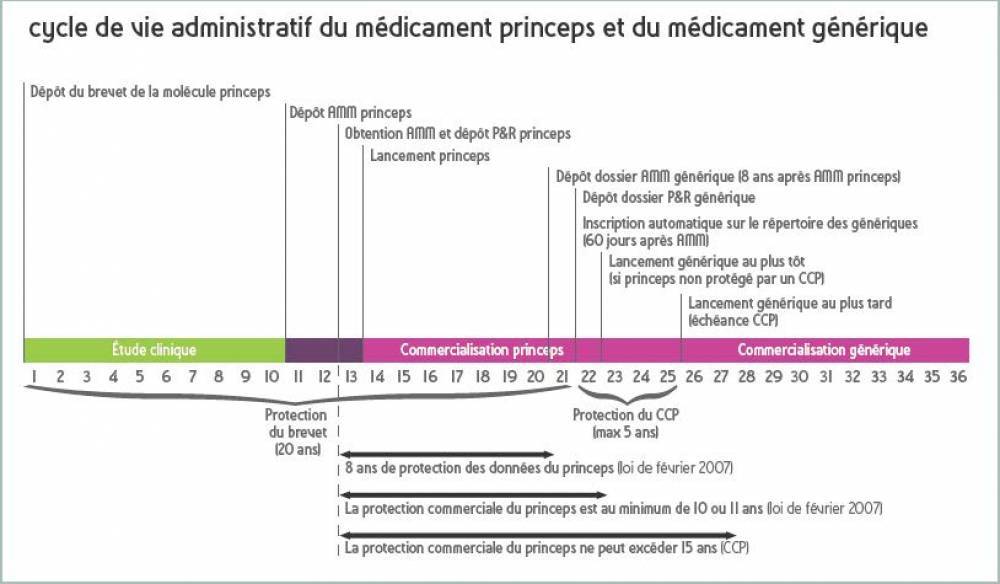
Le cycle de vie du médicament princeps se compose de deux phases :- une phase d'expérimentation de 10 ans pour obtenir l’AMM d'une autorité compétente ;
- puis une phase d’utilisation de 10 ans après sa commercialisation et à l’issue de laquelle le brevet tombe dans le domaine public.
Les médicaments génériques sont donc des médicaments déjà connus au moment de leur commercialisation.
Un médicament qui aurait fait l’objet d’un retrait d’autorisation pour des raisons de sécurité ne pourra pas devenir un générique.
Un médicament générique ne peut être commercialisé qu’à l’échéance du ou des brevets qui protègent le médicament d'origine.
Repères : principe actif et excipients
Le principe actif ou substance active, est le composant du médicament responsable de l’effet thérapeutique.La composition qualitative et quantitative en principe actif d'un médicament générique est identique à celle de son médicament d'origine. Il en est de même de sa forme pharmaceutique (comprimé, gélule, sirop, patch).
L’excipient désigne toute substance autre que le principe actif présente dans un médicament. Il n'a aucune activité pharmacologique recherchée. Tous les médicaments, génériques et princeps, ont des excipients.
Le médicament générique n'est pas nécessairement strictement identique au médicament original : il peut notamment contenir des excipients différents.
Un médicament générique peut être intéressant car il peut ne pas contenir un excipient à effet notoire (réaction allergique par exemple, ou syndrome d’intolérance particulier) contenu dans le princeps.
Les excipients à effets notoires sont mentionnés dans le répertoire des groupes génériques pour aider à la substitution.
À retenir
Le médicament générique peut contenir des excipients différents de ceux du princeps et présenter ainsi un aspect, une couleur ou un goût différent.
Ces différences peuvent être recherchées avec le générique. Un médicament générique peut ainsi être intéressant car il peut ne pas contenir un excipient à effet notoire contenu dans le princeps (comprimé moins gros, goût fraise au lieu de banane, etc.).
Le médicament générique n'est pas nécessairement strictement identique au médicament original : il peut notamment contenir des excipients différents.
Ces différences peuvent être recherchées avec le générique. Un médicament générique peut ainsi être intéressant car il peut ne pas contenir un excipient à effet notoire contenu dans le princeps (comprimé moins gros, goût fraise au lieu de banane, etc.).
Le médicament générique n'est pas nécessairement strictement identique au médicament original : il peut notamment contenir des excipients différents.

Les règles de la substitution
Pour le médecin prescripteur
Le droit de substitution peut s’exercer entre :- spécialité de référence et spécialité générique ;
- spécialité générique et une autre ;
- spécialités à base de plantes du groupe concerné.
- Substitution d’une spécialité ne contenant pas d’excipient à effet notoire : il est recommandé de choisir un générique dépourvu de tout excipient à effet notoire.
- Substitution d’une spécialité contenant un ou plusieurs excipients à effet notoire : il est recommandé de choisir un générique contenant le ou les même(s) excipient(s) à effet notoire ou une spécialité générique partiellement ou totalement dépourvue de ces excipients à effet notoire.
La prescription en DC (article R.5125-55 du CSP) doit comporter au moins :
- le(s) principes actif(s) désigné(s) par sa(leur) DC ;
- le dosage en principe(s) actif(s) ;
- la forme pharmaceutique et la voie d'administration.
Depuis le 1er janvier 2020
La loi de financement de la sécurité sociale pour 2019 a modifié les conditions de substitution des médicaments par leurs génériques et rend obligatoire la justification médicale de la mention "non substituable" (article 66, L. 5125-23 du CSP) .
En l’absence de cette justification, le remboursement par l’Assurance Maladie sera fondé sur le prix du médicament générique le plus cher.
Le médecin peut inscrire la mention non substituable dans trois situations décrites dans l’Arrêté du 12 novembre 2019 :
En cas de refus du patient de délivrance du médicament générique :
Le pharmacien peut choisir de ne pas effectuer de substitution même sans mention de non substitution par le prescripteur, s’il estime que le changement peut influer sur la qualité des soins délivrés au patient pour les médicaments à marge thérapeutique étroite ou en cas de rupture de stock nationale avérée.
En l’absence de cette justification, le remboursement par l’Assurance Maladie sera fondé sur le prix du médicament générique le plus cher.
Le médecin peut inscrire la mention non substituable dans trois situations décrites dans l’Arrêté du 12 novembre 2019 :
- prescription chez les enfants de moins de 6 ans, quand aucun médicament générique n’a une forme galénique adaptée et que le médicament de référence disponible permet cette administration ;
- prescription pour un patient présentant une contre-indication formelle et démontrée à un excipient à effet notoire présent dans tous les médicaments génériques disponibles, et absent dans le médicament de référence ;
- prescription de médicament à marge thérapeutique étroite (lorsque le patient est stabilisé avec un médicament à marge thérapeutique étroite). L’arrêté du 12 novembre 2019 mentionne la liste des substances actives concernées. Celle-ci est susceptible d’évoluer en fonction de l’arrivée de nouveaux génériques sur des médicaments d’origine concernés.
- EFG : il n’existe pas de générique ayant une Forme Galénique adaptée à l’âge de l’Enfant (moins de 6 ans).
- CIF : le patient est allergique à un excipient a effet notoire (Contre-Indication Formelle) qui est absent dans le princeps et présent dans tous les génériques. C’est une situation rare (une douzaine de princeps), car les génériques ont le plus souvent les même excipients que le princeps, voire ont une formulation sans excipient à effet notoire.
- MTE : le médicament à Marge Thérapeutique Etroite fait partie de la liste de l’arrêté du 12 novembre 2019.
Pour le pharmacien qui délivre le traitement
Les pharmaciens sont autorisés depuis 1999 à substituer selon les règles précises fixées par le législateur :- la spécialité dispensée par substitution doit appartenir au même groupe générique que la spécialité prescrite ;
- le médecin ne doit pas s’être opposé à la substitution par l’apposition de la mention "non substituable " sur l’ordonnance ;
- la substitution ne doit pas entraîner de dépense supplémentaire pour l’Assurance maladie.
En cas de refus du patient de délivrance du médicament générique :
- le patient doit s’acquitter auprès de la pharmacie du prix du médicament délivré (il n’y a pas de tiers payant possible pour ce médicament de l’ordonnance) ;
- l’Assurance Maladie rembourse le patient sur la base du prix du médicament générique le plus cher.
Le pharmacien peut choisir de ne pas effectuer de substitution même sans mention de non substitution par le prescripteur, s’il estime que le changement peut influer sur la qualité des soins délivrés au patient pour les médicaments à marge thérapeutique étroite ou en cas de rupture de stock nationale avérée.
Le répertoire des génériques
C'est l’outil sur lequel le pharmacien d’officine se base pour délivrer les médicaments génériques et les médicaments à base de plantes substituables.Les spécialités figurant dans le répertoire sont classées par groupes. Chaque groupe comporte une spécialité de référence et ses génériques. Le pharmacien n’est autorisé à substituer entre elles que les spécialités inscrites dans un même groupe.
Le répertoire s’utilise en lien avec la base de données publique des médicaments. Celle-ci donne accès à toute l’information pour les professionnels (RCP) et les utilisateurs (notice) concernant les produits commercialisés.