Organiser les vigilances
Le système des vigilances s’organise autour du recueil et de l’analyse des déclarations d’événements indésirables. Ce système a pour but d’identifier le plus tôt possible les signaux d’alerte inattendus observés lors d’une utilisation large des produits de santé, et ainsi mettre en place les mesures de santé publique nécessaires pour garantir la sécurité des patients.
L’ANSM est responsable de 5 vigilances
La pharmacovigilance
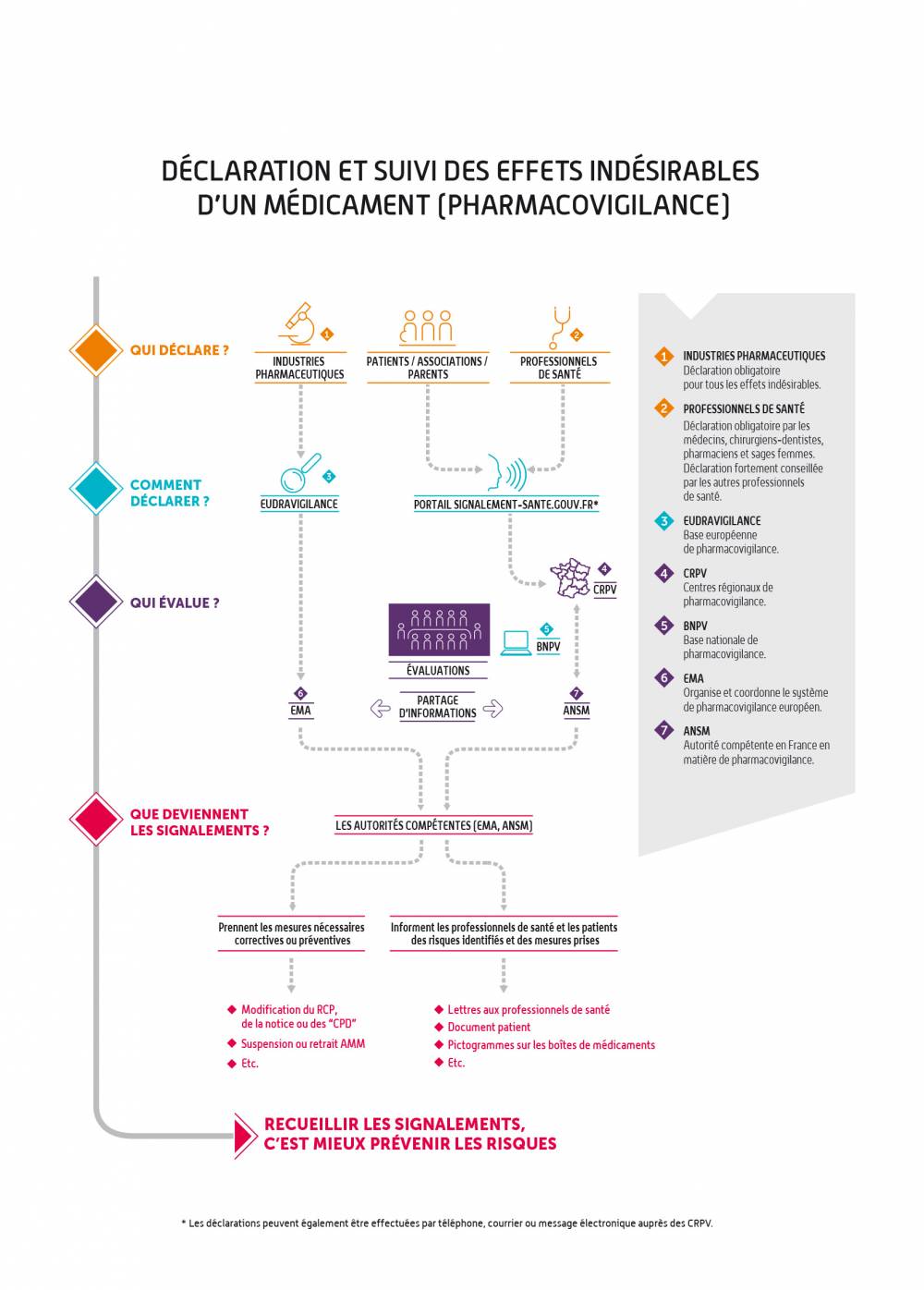
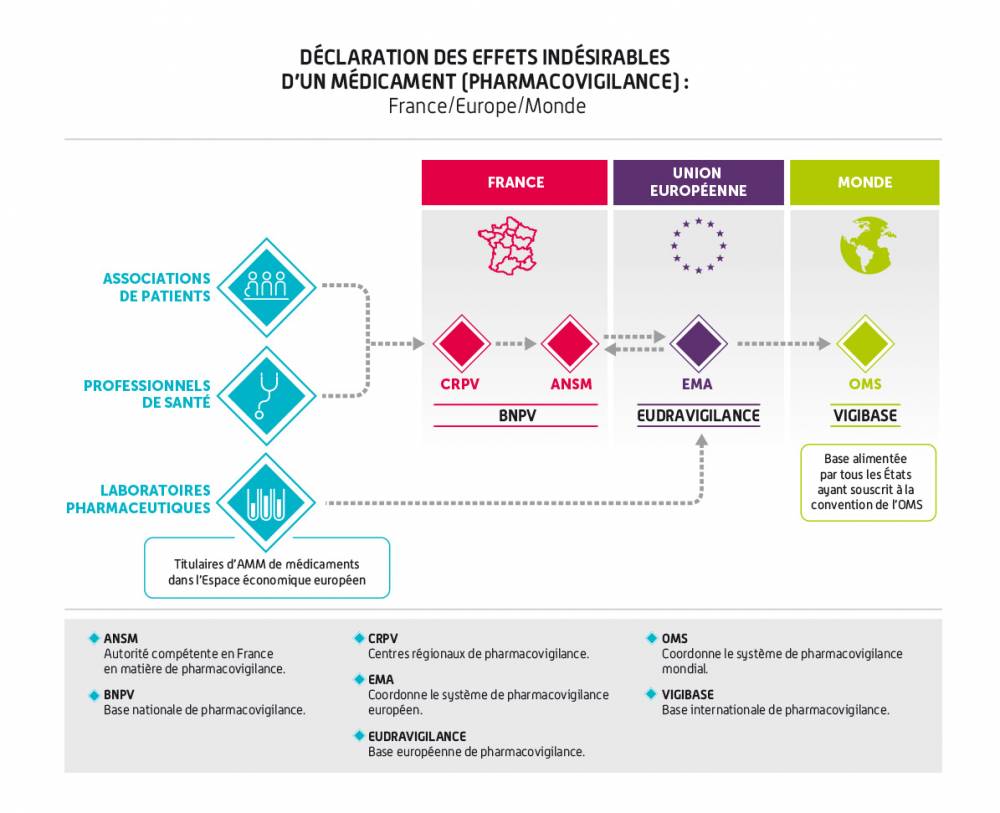
La pharmacovigilance s’exerce sur tous les médicaments utilisés par les patients en France : elle s’intéresse aux effets indésirables survenant dans les conditions normales d’utilisation du médicament, mais aussi aux effets indésirables survenant dans le cadre d’erreurs médicamenteuses, d’abus, de mésusages, de surdosages et d’expositions professionnelles.Elle repose sur un échelon régional avec les centres régionaux de pharmacovigilance (CRPV, au nombre de 31), un échelon national avec l’ANSM et un échelon européen avec l’Agence européenne du médicament (EMA) et les États membres.
La déclaration est alors enregistrée par un centre régional de pharmacovigilance (CRPV) dans une base de données nationale de pharmacovigilance, appelée BNPV. Cette base de données est accessible à l’ensemble des CRPV et à l’ANSM.
La déclaration fait l’objet d’une analyse par le CRPV : le CRPV investigue le cas déclaré et échange si nécessaire avec le professionnel de santé et/ou le patient qui a fait la déclaration. Il détermine par la suite l’imputabilité du médicament dans l’effet indésirable remonté, notamment au regard des données déjà connues, du contexte d’utilisation et du profil du patient concerné.
Les CRPV portent à la connaissance de l’ANSM les déclarations qui constituent des signaux potentiels, appelés “cas marquants”, et réalisent des travaux d’expertise. Ces expertises permettent de confirmer ou d’infirmer et de caractériser le cas échéant un signal ou un risque.
En parallèle, les laboratoires pharmaceutiques ont l’obligation de transmettre directement les déclarations d’effets indésirables médicamenteux qu’ils recueillent à la base européenne de pharmacovigilance (EudraVigilance).
L’ANSM est en relation permanente avec les CRPV afin d’identifier tout nouveau risque ou évolution d’un risque connu.
Elle se saisit alors des signaux remontés, les analyse au travers de son expertise médicale, scientifique et technique, et échange avec les représentants des professionnels de santé et patients concernés. L’ANSM peut également mobiliser un CRPV pour mener des enquêtes complémentaires sur un ensemble de déclarations en vue de mieux caractériser un risque potentiel ou connu.
Le cas échéant, l’ANSM met en place les mesures nécessaires destinées à prévenir ou réduire les risques afin d’assurer la sécurité d’emploi des médicaments, en concertation avec les partenaires externes.
L’ANSM participe activement aux groupes de travail européens, en particulier au Comité pour l’évaluation des risques en matière de pharmacovigilance (PRAC), qui permettent de suivre et de répondre aux évolutions du rapport bénéfice/risque des médicaments : arbitrages, signaux, études de sécurité post-AMM, etc.
L’ANSM peut également être sollicitée pour mener une évaluation scientifique sur un médicament (ou une classe de médicaments) pour le compte de l’Union européenne, dans le cadre d’une procédure d’arbitrage. Cette procédure est utilisée pour répondre à une préoccupation concernant la sécurité ou le rapport bénéfice/risque d’un médicament ou encore pour régler un désaccord entre Etats membres sur l’usage d’un médicament. Elle a pour finalité de fournir une recommandation harmonisée au sein de l’Union européenne.
Par ailleurs, l’ANSM et les laboratoires alimentent quotidiennement la base de données de l’Agence européenne des médicaments (EMA), appelée EudraVigilance. Cette base de données est le point de collecte unique en Europe de tous les effets indésirables graves et, depuis novembre 2017, des effets indésirables non graves survenus en Europe.
Au niveau international, l’Organisation mondiale de la Santé a mis en place en 1968 une base de données internationale de pharmacovigilance : VigiBase. C'est la banque de données la plus importante et complète dans le monde. Elle est maintenue par le centre de surveillance d’Uppsala (UMC) sous mandat de l’OMS. Plus de 150 pays participent à la collecte des données de pharmacovigilance. La France participe au programme depuis 1986. La France est le 7e pays contributeur, avec environ 2,5 % du nombre total de cas d’effets indésirables recueillis.
L'addictovigilance
L’addictovigilance est la surveillance, l’évaluation, la prévention et la gestion du risque d'abus, d'usage détourné et de pharmacodépendance lié à la consommation, qu’elle soit médicamenteuse ou non, de toute substance psychoactive (plante ou produit), à l’exclusion de l’alcool et du tabac.A l’échelle nationale, l’’addictovigilance repose sur un réseau de 13 Centres d’Evaluation et d’Information sur la pharmacodépendance - Addictovigilance (CEIP-A) piloté par l’ANSM.
Par ailleurs, les laboratoires pharmaceutiques ont l’obligation de transmettre directement les déclarations d’effets indésirables médicamenteux qu’ils recueillent à la base européenne de pharmacovigilance (EudraVigilance).
Les outils de surveillance
La détection des signalements marquants en addictovigilance
Un signalement marquant en addictovigilance dit SIMAD correspond à une ou plusieurs notifications d'abus, de dépendance, d'usage détourné, de trafic (don, deal, achat de rue, revente, ordonnance falsifiée, Internet etc.) ou tout autre trouble d'usage d'une substance psychoactive, médicamenteuse ou non, à l'exception de l'alcool et du tabac, rapporté par un CEIP-A à l’ANSM.Il peut s'agir d'une situation avec un effet clinique rapporté ou impliquant une (ou plusieurs) substance(s) et un usager identifié ou non reliée à un usager précis ou d'une situation sans effet clinique rapporté, comme par exemple un signalement d'ordonnance(s) falsifiée(s).
Les enquêtes d’addictovigilance
L’enquête nationale d’addictovigilance a pour objectif l’évaluation du risque d’abus, de dépendance, de mésusage et d’usage détourné d’une substance psychoactive médicamenteuse ou non afin de confirmer un signal potentiel, caractériser un signal avéré, surveiller le profil de risque d’un médicament, ou mesurer l’impact d’une mesure réglementaire.L’enquête est réalisée par un expert rapporteur, assisté d’un expert relecteur, membres des CEIP-A, sur demande de l’ANSM. La conduite de l’enquête doit répondre aux objectifs fixés par l’ANSM dans les délais impartis
Les outils spécifiques du réseau d’addictovigilance
Le réseau d’addictovigilance réalise des enquêtes pharmacoépidémiologiques annuelles permettant de surveiller les consommations des substances psychoactives :- en centre de soins spécialisé dans la prise en charge des usagers de drogues (OPPIDUM : observation des produits psychotropes illicites ou détournés de leur utilisation médicamenteuse),
- en pharmacie de ville (OSIAP : ordonnances suspectes, indicateurs d’abus possible, ASOS : antalgiques stupéfiants et ordonnances sécurisées)
- auprès des analystes toxicologues (DRAMES : décès en relation avec l’abus de médicaments et de substances, DTA : décès toxiques par antalgiques, Soumission chimique).
La veille des bases de données de surveillance
Les cas d’abus et de dépendance impliquant un médicament doivent être saisis dans la BNPV. La BNPV peut être consultée dans le cadre d’une enquête ou pour vérifier un signalement.SINTES vise à apporter une meilleure connaissance du contenu toxicologique des drogues illicites à travers :
- un volet observation (synthèse des données d'analyses toxicologiques des produits saisis, et mise en oeuvre de recueils spécifiques auprès d'usagers)
- et un volet veille (avec notamment l'analyse toxicologique de produits nouveaux ou à l'origine d'effets inattendus).
- Consultez le site de l'OFDT
La participation au système européen d'addictovigilance
L’ANSM participe au système d’échange d’information et d’évaluation des risques. Ce dispositif, mis en place à l’échelle européenne, évalue les substances psychoactives de faible intérêt thérapeutique. Ce dispositif permet aussi de déclencher des alertes sur les risques liés à ces substances, qui sont diffusées à l'ensemble des Etats membres. Ce dispositif fonctionne en réseau, avec 15 centres d’informations situés dans les différents Etats membres. Ces centres recueillent et analysent les données sur les drogues.Que fait l’ANSM ?
- L’ANSM transmet à l'EUDA (European Union Drugs Agency) des rapports d’évaluation réalisés par les CEIP-A.
- Elle transmet à l'Agence Européenne d'Evaluation des Médicaments, l’EMEA, les cas d’abus liés à la consommation de spécialités pharmaceutiques.
- Elle évalue les risques d’abus et de dépendance, induits par la consommation de spécialités pharmaceutiques dans le cadre d’une procédure d’enregistrement européenne.
La participation au système international d'addictovigilance
L’OMS et l’ONU demandent aux Etats de mettre en place des mesures de prévention, de formation et d’information à destination des professionnels de santé et du grand public.Que fait l’ANSM ?
- L’ANSM transmet des rapports nationaux d’évaluation des substances psychoactives, effectués par les CEIP-A, au Comité d’experts sur la pharmacodépendance de l’OMS (organisation mondiale de la santé).
- L’ANSM participe à la Commission des stupéfiants des Nations Unies. Elle peut proposer ou appuyer des résolutions.
L'hémovigilance
L’hémovigilance est la surveillance, l’évaluation et la prévention des incidents et effets indésirables, survenant chez les donneurs et les receveurs de produits sanguins labiles. Cette surveillance s’applique à l’ensemble de la chaîne transfusionnelle, c’est-à-dire depuis la collecte des produits sanguins labiles jusqu’au suivi des receveurs.L'hémovigilance surveille et évalue :
- les effets indésirables survenant chez les donneurs de sang (EID)
- les informations post don (IPD), susceptibles de compromettre la qualité ou la sécurité des produits sanguins issus de ces dons ou de dons antérieurs
- les incidents de la chaine transfusionnelle, de la collecte des PSL au suivi des receveurs
- les effets indésirables survenant chez les receveurs de PSL (Produits Sanguins Labiles)
La sécurité transfusionnelle a pour objectif d'identifier les dangers ayant causé, causant ou susceptible de causer des incidents ou des effets indésirables qui ont menacé, menacent ou peuvent menacer la santé des donneurs ou des receveurs afin d'en éliminer ou d'en réduire les risques associés.
Le système d'hémovigilance repose sur des échelons local, régional et national.
L’ANSM fixe les grands axes et les objectifs du système d’hémovigilance, pilote les missions des différents acteurs. Dans certains cas, elle peut saisir les autorités compétentes.
- L’ANSM reçoit les déclarations des différents acteurs. Elle est également tenue informée de la survenue d’obstacles à la qualité et la sécurité des étapes de la chaîne transfusionnelle. Par ailleurs, elle reçoit les données issues de la surveillance épidémiologique des donneurs de sang.
- L’ANSM peut effectuer des enquêtes épidémiologiques avec l’Etablissement français du sang (EFS), le Centre de transfusion sanguine des armées (CTSA), le Centre national de référence (CNR) du VIH et des virus des hépatites B et C en transfusion sanguine de l’Institut national de la transfusion sanguine (INTS).
Ces enquêtes épidémiologiques permettent d’observer et d’analyser les problèmes de santé au sein de la population, et d’en déterminer les causes, les facteurs de risque. - L’ANSM peut réaliser des études, par exemple des études relatives aux conditions d’utilisation des produits sanguins labiles, dans le cadre du réseau d'hémovigilance qui sont chargés d'assurer la transmission des données relatives à la sécurité sanitaire des produits sanguins.
Déclaration et évaluation des EIR, EIGD, IG et IPD
Tout professionnel de santé (infirmier, médecin, pharmacien, sage-femme, chirurgien-dentiste etc.) qui constate ou a connaissance d'un IG, d’un EIGD, d'un EIR, d'une IPD le (la) signale sans délai au correspondant d'hémovigilance et de sécurité transfusionnelle (CHV-ST) de l’établissement de santé ou l'établissement transfusion sanguine où l'incident est survenu ou l’effet indésirable a été constaté.Le CHV-ST le déclare dans le système national de télé-déclaration e-FIT dédié à l’hémovigilance. La déclaration enregistrée est accessible en temps réel à tous les acteurs du réseau d’hémovigilance concernés par cette déclaration notamment les CRH-ST et l’ANSM.
La déclaration fait l’objet d’une analyse au fil de l’eau par le CRH-ST concerné et l’ANSM. Elle fait l’objet d’échanges tout au long de son cycle de vie entre les CHV-ST, le CRH-ST et l’ANSM jusqu’à la fin des investigations, afin de déterminer notamment l’imputabilité du (des) PSL concerné(s) dans la survenue de l’effet indésirable déclaré, au regard des données déjà connues, du contexte d’utilisation et du profil du patient concerné.
Le système d’hémovigilance à l’échelon local
A l’échelon local, trois catégories d’acteurs participent au système d’hémovigilance :Les correspondants des établissements de transfusion sanguine
Ils doivent déclarer sans délai à l’ANSM :- tout effet indésirable survenu chez un receveur de PSL,
- tout effet indésirable grave survenu chez un donneur de sang,
- tout incident grave de la chaîne transfusionnelle,
- toute information post-don.
Les correspondants des établissements de santé
Ils doivent déclarer à l’ANSM :- tout effet indésirable survenu chez un receveur de produits sanguins labiles,
- tout incident grave.
Les professionnels de santé
Ils doivent signaler sans délai au correspondant concerné :- tout effet indésirable survenu chez un receveur de produits sanguins labiles,
- tout effet indésirable grave survenu chez un donneur de sang,
- tout incident grave,
- toute information post-don.
Le système d’hémovigilance à l’échelon régional
Les coordonnateurs régionaux d'hémovigilance et de sécurité transfusionnelle (CRH-ST) travaillent auprès du directeur de l’Agence régionale de santé et veillent à l’application :- des règles et consignes propres à l’hémovigilance,
- des décisions de l’ANSM,
- des actions entreprises par les établissements de santé chargés de l’hémovigilance et de la sécurité transfusionnelle. Ils assurent notamment le suivi de la mise en place de l’hémovigilance ainsi que la mise en place des mesures préventives et correctives proposées par les ES et les ETS.
La contribution de la France à l’hémovigilance européenne
- Commission Européenne (CE) : les Etats Membres (EM) Européens remontent les signaux à la Commission permettant leur partage avec les autres EM via d’une part la plateforme d’alerte européenne dans le domaine du sang, RAB (Rapid Alert Blood) et d’autre part les rapports annuels de chacun des EM
- Sous-groupe vigilance des substances issues du corps humain de la CE : les évènements marquants y sont discutés avec le Conseil de l’Europe (CoE) en vue de partager les actions correctives potentielles de la CE avec les EM
L’ANSM participe activement aux groupes de travail européens compétents en matière de vigilance, en particulier au sous-groupe vigilance, qui permettent de suivre les évolutions des systèmes nationaux d’hémovigilance et d’identifier les signaux d’intérêt pour l’UE.
Elle est régulièrement sollicitée dans ce contexte pour des enquêtes dans le champ de l’hémovigilance et plus largement dans le domaine de la transfusion.
Elle participe au dispositif RAB d’alerte dans le domaine du sang.
La contribution de la France à l’hémovigilance internationale
- Organisation mondiale de la Santé (OMS)
- Réseau international d’hémovigilance : IHN (International Haemovigilance Network)
- Société internationale de transfusion sanguine : ISBT (international society of blood transfusion).
La matériovigilance
La matériovigilance évalue les incidents et les risques d’incident mettant en cause un dispositif médical. Elle s'exerce dès la phase des essais cliniques et tout au long de leur cycle de vie.Le système de matériovigilance repose sur un échelon national (ANSM), un échelon local confié à des correspondants locaux de matériovigilance situés dans les établissements de santé publics ou privés, à des professionnels de santé et des fabricants, tous tenus de signaler à l’ANSM les incidents ou risques d’incident dont ils ont connaissance, et à titre expérimental, sur un échelon régional constitué de correspondants régionaux de matériovigilance.
Cette surveillance peut aboutir à la prise de mesures préventives et correctives pour éviter que se (re)produisent des incidents ou des risques d’incident graves.
La collecte et l’enregistrement des données par l’ANSM
Ces données sont transmises par :- les correspondants locaux de matériovigilance des établissements de santé,
- les fabricants,
- les industriels,
- les utilisateurs et les tiers.
- les incidents ou risques d'incidents graves,
- les actions correctives ou les rappels de dispositifs médicaux du marché mises en place par les fabricants.
L’évaluation des incidents par l'ANSM
Quatre types d’incidents sont évalués.- Les incidents mineurs : ce sont des incidents peu graves. Le fabricant n’est pas obligé d’apporter d’informations complémentaires.
- Les incidents majeurs : dans ce cas, le fabricant est obligé d’effectuer une investigation, qui peut être accompagnée d’une expertise du dispositif, réalisée par lui-même ou par un tiers.
- Les incidents critiques : ces incidents font l’objet d’une évaluation immédiate et peuvent être accompagnés d’une mesure sanitaire. Des informations complémentaires doivent être recueillies auprès du fabricant et du déclarant.
- L’évaluation globale : les incidents évalués sont connus, surviennent fréquemment, et peuvent être graves. Ils mettent en cause un type de dispositif particulier. Ils sont collectés et font l’objet d’une analyse statistique.
Les informations et alertes communiquées par l’ANSM
On distingue trois types d’informations et alertes :- les informations ou recommandations (émises par l’ANSM à destination des établissements de santé ou des pharmaciens d’officine),
- les actions correctives ou rappels (validés par l’ANSM et émis par le fabricant, à destination des établissements de santé ou des utilisateurs),
- les décisions de police sanitaire (prises par l’ANSM à destination des fabricants et les autres opérateurs du marché : distributeurs, mandataires...).
La réactovigilance
La réactovigilance évalue les incidents et les risques d’incident liés à l’utilisation des dispositifs médicaux de diagnostic in vitro (DMDIV).
Le système de réactovigilance repose sur un échelon national (ANSM), un échelon local confié à des correspondants locaux de reactovigilance situés dans les établissements de santé publics ou privés, à des professionnels de santé et des fabricants, tous tenus de signaler à l’ANSM les incidents ou risques d’incident dont ils ont connaissance, et à titre expérimental, sur un échelon régional constitué de correspondants régionaux de réactovigilance.
Cette surveillance peut aboutir à la prise de mesures préventives et correctives pour éviter que se (re)produisent des incidents ou des risques d’incident graves.
L’évaluation des incidents et risques d’incident
Quatre types d’incidents sont évalués.- Les incidents mineurs : ce sont des incidents peu graves. Le fabricant n’est pas obligé d’apporter d’informations complémentaires.
- Les incidents majeurs : dans ce cas, le fabricant est obligé d’effectuer une investigation, qui peut être accompagnée d’une expertise du dispositif, réalisée par lui-même ou par un tiers.
- Les incidents critiques : ces incidents font l’objet d’une évaluation immédiate et peuvent être accompagnés d’une mesure sanitaire. Des informations complémentaires doivent être recueillies auprès du fabricant et du déclarant.
- L’évaluation globale : les incidents évalués sont connus, surviennent fréquemment, et peuvent être graves. Ils mettent en cause un type de dispositif particulier. Ils sont collectés et font l’objet d’une analyse statistique.
Les informations et alertes communiquées par l’ANSM
L’ANSM, en concertation avec les fabricants, adresse deux types de courriers aux correspondants locaux de réactovigilance, aux responsables de laboratoire mais également aux directeurs d’établissement et aux utilisateurs :- des courriers d’information et de recommandations,
- des courriers de retrait.
- les suspensions de fabrication, d’importation, de mise sur le marché,
- l’interdiction des activités ayant entrainé des incidents,
- l’application de restrictions ou de conditions particulières d’utilisation des dispositifs médicaux.